时间:2017-08-26 02:57:26
1、填空题 I,已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸K =1.75×10-5
碳酸K1=4. 30×10-7 K2=5.61×10-11
亚硫酸K1=1.54×10-2 K2=1.02×10-2
(1)写出碳酸的第一级电离平衡常数的表达式:K1=___。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:____>____>___ 。
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是___(填序号)。
A.c(CH3COO -)
B.c(H+)
C.醋酸电离平衡常数
D.醋酸的电离程度
Ⅱ,某化工,一废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01 mol.L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
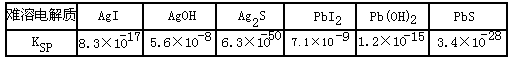
参考答案:(1)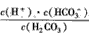
(2)H2CO3 ;HSO3- ;HCO3-
(3)AD
(4)B
(5)9×10 -9 mol . L-1
本题解析:
本题难度:一般
2、简答题 用实验确定某酸HA是弱电解质.两同学的方案是:
甲:
①称取一定量的HA的配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质.
乙:
①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质.
(1)在两个方案的第①步中,都用到的定量仪器是______.
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH______1(选填“>”、“<”、“=”).乙方案中,说明HA是弱电解质的现象是______(填字母序号,多选倒扣分).
a.装HCl的试管中放出H2的速率快;
b.装HA溶液的试管中入出H2的速率快;
c.两个试管中产生气体速率一样快.
(3)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述.______.
参考答案:(1)在两个方案的第①步中,配制0.1mol/L的溶液100mL、别配制pH=1的两种酸溶液各100mL,根据配制一定浓度的溶液必须使用容量瓶,故答案为:100mL的容量瓶;
(2)配制0.1mol/L的HA酸溶液100mL,弱电解质的电离是可逆的,不能完全电离,用pH试纸测出该溶液的pH值,如果是pH>1即为弱酸,pH=1即为强酸,各取相同体积、pH=1的两种酸溶液装入两个试管,同时加入纯度相同的锌粒,装HA溶液的试管中入出H2的速率快,故答案为:>;b;
(3)弱酸的强碱盐可以水解,水解显示碱性,可以配制NaA溶液,如果测定其pH>7,即可以证明HA是弱电解质,故答案为:配制NaA溶液,测定pH>7,即可以证明HA是弱电解质.
本题解析:
本题难度:一般
3、选择题 已知反应KI+I2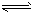 KI3,下列推断错误的是
KI3,下列推断错误的是
[? ]
A.I3-在溶液中存在如下平衡:I3-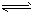 I-+I2
I-+I2
B.将Cl2通入KI3溶液中,I3-的浓度不会改变
C.配制碘水时,加入KI可增大I2的溶解度
D.在KI3溶液中加入淀粉溶液可变蓝色
参考答案:B
本题解析:
本题难度:一般
4、选择题 pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
A.x为弱酸,Vx<Vy
B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy
D.y为强酸,Vx>Vy
参考答案:C
本题解析:
本题难度:一般
5、选择题 草酸是二元中强酸,测得0.01 mol·L-1的草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,下列说法正确的是
A.V(NaOH) = 0时, c(Na+)> c(H+)> c(HC2O4- )> c(C2O42-)> c(OH-)
B.V(NaOH) = 5时, c(Na+)=c(C2O42-)+c(HC2O4- )+c(H2C2O4)
C.V(NaOH) =" 10" mL时, c(Na+) = c(HC2O4- )+2c(C2O42-)
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )
参考答案:D
本题解析:A选项c(Na+)> c(HC2O4- ) > c(H+) > c(OH-)>c(C2O42-)
B选项物料守恒不 正确;C选项电荷守恒不正确
本题难度:一般