时间:2017-08-26 02:29:34
1、选择题 下列实验方法正确的是
[? ]
A.用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
B.用浓盐酸雕刻玻璃制工艺品
C.用溶解、过滤的方法提纯含有少量Na2SO4的K2CO3固体
D.用酒精可以从碘水中萃取碘?
参考答案:A
本题解析:
本题难度:一般
2、选择题 将等体积的四氯化碳、溴苯和水在试管中充分混合后静置。下列图示现象正确的是
[? ]
A.
B.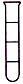
C.
D.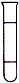
参考答案:C
本题解析:
本题难度:简单
3、选择题 你在粗盐的提纯实验中,三个主要实验操作步骤顺序为( )
A.溶解、过滤、蒸发
B.过滤、蒸发、溶解
C.溶解、蒸发、过滤
D.过滤、溶解、蒸发
参考答案:在粗盐提纯时,要先将粗盐固体溶解配成溶液,然后利用过滤的方法除去不溶性杂质,最后将滤液中的水分蒸发使晶体析出即可.
故选:A.
本题解析:
本题难度:一般
4、选择题 120mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A.2.0 mol/L
B.0.18 mol/L
C.1.5 mol/L
D.0.24 mol/L
参考答案:C
本题解析:试题分析:当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,
当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,则HCl的物质的量应大于Na2CO3的物质的量,又因为最终生成的气体体积不同,
则HCO3-+H+=H2O+CO2不能全部完成,即HCl的物质的量比Na2CO3的物质的量的二倍少,
碳酸钠的物质的量为0.2mol,
则HCl的物质的量应介于0.2mol~0.4mol之间,
盐酸溶液的体积为200mL=0.2L,
即盐酸的浓度应该是大于1mol/L,小于2mol/L。
故选C。
考点:有关范围讨论题的计算 钠的重要化合物
点评:本题考查学生利用盐酸与碳酸钠的反应分析盐酸的浓度,明确反应发生的先后顺序,通过比较及信息中都有气体产生,但最终生成的气体体积不同是解答的关键。
本题难度:简单
5、填空题 (10分)用一种试剂除去下列物质中的杂质(括号中为杂质),写出所用试剂及离子方程式。(1)Na2SO4溶液(CuSO4)
除杂试剂:?,离子方程式:? ?。
?。
(2)FeCl2溶液(CuCl2)
除杂试剂:?,离子方程式:?。
参考答案:(1)NaOH溶液(2分) ,Cu2++2OH- ="==" Cu(OH)2↓?(3分)
,Cu2++2OH- ="==" Cu(OH)2↓?(3分)
(2)Fe粉(2分),? Fe+ Cu2+ ="==" Fe2++ Cu?(3分)
本题解析:略
本题难度:一般