时间:2017-08-26 02:29:34
1、选择题 要除去MgCl2酸性溶液里少量的FeCl3,不宜选用的试剂是
[? ]
A.MgO
B.MgCO3
C.NaOH
D.Mg(OH)2
参考答案:C
本题解析:
本题难度:一般
2、选择题 若NA代表阿伏加德罗常数的数值,下列叙述正确的是
A.标准状况下,5.6L?CCl4含有的C-Cl共价键数为NA
B.2.4g?Mg与足量稀硫酸反应时,失去电子数为0.1NA
C.1?L0.5mol/L?CuCl2?溶液中含有的?Cu2+数为0.5NA
D.16g氧气和臭氧的混合物中氧原子数为NA
参考答案:D
本题解析:分析:A.标准状况下CCl4是液体;
B.一个镁原子失去2个电子;
C.Cu2+能发生水解;
D.氧气和臭氧是同素异形体,组成一样,原子个数等于质量比摩尔质量乘以阿伏伽德罗常数.
解答:A.标准状况下CCl4是液体,5.6L?CCl4的物质的量不是0.25mol,故A错误;
B.2.4g?Mg的物质的量是0.1mol,失去电子数为0.2NA,故B错误;
C.氢氧化铜是弱电解质,Cu2+能发生水解,Cu2+数小于0.5NA,故C错误;
D.氧气和臭氧是同素异形体,成分一样,原子个数等于质量比摩尔质量乘以阿伏伽德罗常数,N= ×NA=
×NA= NA=NA,故D正确.
NA=NA,故D正确.
故选D.
点评:本题考查阿伏加德罗常数,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.
本题难度:困难
3、选择题 能用分液漏斗分离的一组混合物是
A.硝基苯和酒精
B.溴苯和溴
C.甲苯和四氯化碳
D.硝基苯和水
参考答案:D
本题解析:只有互不相溶的液体之间才能用分液漏斗进行分离,据此可知,选项D正确。其余选项都是易溶或互溶的,答案选D。
点评:该题的高考中的常见题型,属于基础性试题的考查。试题基础性强,主要是考查学生对分液漏斗进行物质分离原理的熟悉掌握程度,有利于培养学生的实验能力。
本题难度:简单
4、选择题 能用溶解、过滤、结晶的方法来分离的一组物质是( )
A.CaO和KCl
B.CuO和NaCl
C.BaSO4和SO3
D.NaCl和AgNO3
参考答案:A.氧化钙与水反应生成氢氧化钙,故A错误;
B.CuO不溶于水,可用过滤分离出,而NaCl能溶于水,可用蒸发结晶分离出来,故B正确;
C.SO3与水反应生成硫酸,故C错误;
D.NaCl和AgNO3反应生成氯化银和硝酸钠,故D错误.
故选:B.
本题解析:
本题难度:一般
5、填空题 氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下: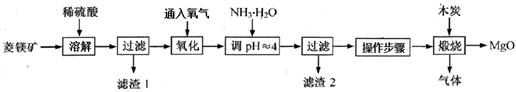
(1)通入O2氧化时,发生反应的离子方程式为____________________。
(2)滤渣2的成分是_________(填化学式)
(3)流程图中“操作步骤”为?、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热?(填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为?。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
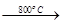 2MgO+2SO2↑+CO2↑; MgSO4+C
2MgO+2SO2↑+CO2↑; MgSO4+C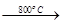 MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;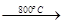 MgO+S↑+3CO↑。
MgO+S↑+3CO↑。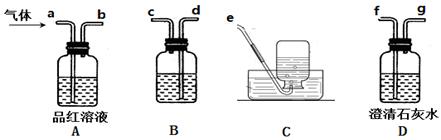
参考答案:(1)4Fe2++O2+4H+=4Fe3++2 H2O(2分) (2)Fe(OH)3(2分)
(3)蒸发浓缩、冷却结晶?(2分,少选一个扣1分)?能?(1分)
(4)MgCO3+H2O= Mg(OH)2+CO2↑(2分)
(5)蓝色(2分)
(6)①B? C (2分,少选一个扣1分)?
②dcabfge(或dcfge)(2分,少选、错选不得分)?酸性高锰酸钾溶液(2分)
后A中品红不褪色,澄清石灰水变浑浊(或B中颜色变浅,澄清石灰水变浑浊)(2分)
本题解析:(1)菱镁矿与硫酸反应生成Fe2+,通入氧气,把Fe2+氧化为Fe3+,离子方程式为:4Fe2++O2+4H+=4Fe3++2 H2O
(2)调节pH至4,Fe3+转化为Fe(OH)3,所以滤渣2的成分是Fe(OH)3。
(3)从MgSO4溶液得到MgSO4·7H2O晶体,先加热蒸发水分,使MgSO4溶液浓度变大,然后降温,MgSO4的溶解度减小,析出MgSO4·7H2O晶体,所以流程图中“操作步骤”为:蒸发浓缩、冷却结晶;将MgSO4?7H2O晶体直接加热会造成结晶水脱去,硫酸镁较稳定,可以稳定存在,所以对MgSO4·7H2O晶体直接加热能得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,化学方程式为:MgCO3+H2O= Mg(OH)2+CO2↑
(5)根据Mg(OH)2的溶度积Ksp=5.6×10-12,可得c(Mg2+)?c2(OH?)= 5.6×10-12,c (OH?)="2" c(Mg2+),可得c3(OH?)=2.246×10-11,可估算出pH>10,故溶液呈现蓝色。
(6)①煅烧固体物质的仪器为坩埚,坩埚需要在放在泥三角上加热,故答案为BC。
②B中溶液的作用为除去SO2,防止干扰CO2的检验,所以B中溶液为:酸性高锰酸钾溶液;首先连接dc,连接ab,品红的作用是证明SO2已完全被除去,在连接fg,用澄清石灰水检验CO2,所以连接顺序为:dcabfge(或dcfge);后A中品红不褪色或B中颜色变浅,,说明SO2已完全除去,澄清石灰水变浑浊,则可证明气体中含CO2.
本题难度:困难