时间:2017-08-26 02:23:23
1、选择题 二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,对下列物质的水溶液中存在的粒子及粒子浓度之间存在的关系判断错误的是
H++A2-,对下列物质的水溶液中存在的粒子及粒子浓度之间存在的关系判断错误的是
A.NaHA:c(Na+)>c(HA-)>c(H+) >c(OH-)
B.NaHA:c(Na+)=c(A2-)+c(HA-)+c(H2A)
C.Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+)
D.H2A: c(H+)=c(HA-)+2 c(A2-)+c(OH-)
参考答案:B
本题解析:B不正确,物料守恒式子为:c(Na+)=c(A2-)+c(HA-),溶液中无H2A。其余正确,D为电荷守恒,选B。
本题难度:一般
2、选择题 0.1?mol·L-1的下列物质的水溶液中,氢离子浓度最大的是
A.NH3·H2O
B.NH4Cl
C.HCl
D.HCOOH
参考答案:C
本题解析:盐酸是强酸,盐所以盐酸溶液中氢离子的浓度最大,酸性最强。答案选C。
本题难度:一般
3、填空题 (10分)工业制备氯化铜时,将浓盐酸用蒸气加热到80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?______,理由是_____________________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是___________(填序号);
A.一定增大 B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?__________,理由是____________________________。
③现有下列几种常用的氧化剂,可用于除去该混合溶液中Fe2+的有_________(填序号)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有__________(填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3
参考答案:(1)不能 因Fe2+沉淀时的pH最大,Fe2+完全沉淀时的Cu2+、Fe3+早已沉淀
①A ②不妥当 引入了新杂质Na+ ③CD (2)C
本题解析:
(1)由题给信息可知,除去Fe2+时,应避免Cu2+生成沉淀,如直接调整溶液pH=9.6,则生成氢氧化亚铁的同时,氢氧化铜、氢氧化铁也同时生成;
①NaClO为强碱弱酸盐,水解呈碱性,则加入NaClO,溶液的pH一定增大,另外NaClO可以酸反应生成HClO而导致溶液pH增大;
②加入氧化剂时,不能引入新的杂质,如用NaClO,则可引入NaCl杂质;
③为避免引入杂质,浓HNO3和KMnO4不能选用,可以用Cl2或O2氧化除去Fe2+;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质,则可用CuO 或Cu(OH)2或CuCO3或Cu2(OH)2CO3。
考点:考查常见的氧化剂、溶液的除杂
点评:本题考查了常见的氧化剂、溶液的除杂,难度不大。解题时应注意选择除杂试剂时,应保证不能引入新的杂质。
本题难度:困难
4、填空题 (9分)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
参考答案:
本题解析:
本题难度:困难
5、填空题 (10分)化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。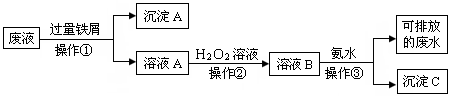
(1)操作①的名称是 。
(2)操作②反应时还需加入少量硫酸,操作②中观察到的实验现象是 。
(3)操作②中发生反应的离子方程式为 。
(4)简述以沉淀A为原料制得金属铜和绿矾晶体(FeSO4·7H2O)的实验方案。
参考答案:(1)过滤 (2)溶液由浅绿色变为棕黄色,有少量气泡出现。
(3)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + H2O
(4)在沉淀中加入稀硫酸,搅拌,至不再有气泡产生,过滤,洗涤固体并干燥得铜。滤液加热浓缩后冷却结晶,过滤,干燥得绿矾。
本题解析:(1)分离溶液和沉淀应用过滤方法(2)溶液A中含亚铁离子,过氧化氢溶液有氧化性,可将亚铁离子氧化成铁离子,铁离子为棕黄色,过氧化氢本身被还原成氧气,故有气泡冒出(3)亚铁离子被氧化,过氧化氢被还原(4)沉淀A含铁和铜,加入稀硫酸将铁转化为FeSO4,再加热浓缩后冷却结晶,过滤,干燥得绿矾。
本题难度:困难