时间:2017-08-26 02:21:31
1、选择题 下列说法不正确的是
A.X+Y=M+N为放热反应,可推知X和Y的总能量一定高于M和N的总能量
B.1molSO2的键能总和大于1mol硫和1mol氧气的键能之和
C.由C(石墨)=C(金刚石)△H=+1.9KJ/mol 可知,金刚石比石墨稳定
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
参考答案:C
本题解析:反应物的总能量高于生成物的总能量,反应就是放热反应。硫烧热是放热反应,所以1molSO2的键能总和大于1mol硫和1mol氧气的键能之和。能量越低体系越稳定,所以石墨比金刚石稳定。物质在气态时的能量高于在固态时的能量,所以等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多。答案是C。
本题难度:一般
2、选择题 下列与化学概念有关的说法正确的是
A.氢、氧两种元素只能组成水
B.不能跟酸反应的氧化物一定能跟碱反应
C.化合反应不一定是氧化还原反应
D.根据是否产生丁达尔效应,将分散系分为溶液、浊液和胶体
参考答案:C
本题解析:氢氧两种元素能组成水、H2O2等物质,A项错误;CO既不能与酸反应,也不能与碱反应,B项错误;部分化合反应是氧化还原反应,例如C与氧气反应,部分化合反应是非氧化还原反应,例如SO3+H2O = H2SO4 ,C项正确;根据分散质微粒直径的大小,将分散系分为溶液、浊液和胶体,D项错误;选C。
考点:考查化学基本概念。
本题难度:一般
3、选择题 下列微粒中只有氧化性的是
①Cl- ②Fe2+ ③Fe3+ ④S ⑤MnO4- ⑥Ag+ ⑦SO2
A.①⑦
B.②④
C.③⑤⑥
D.②④⑤⑥
参考答案:C
本题解析:根据元素化合价的高低判断微粒的氧化性、还原性,最高价态的只有氧化性,最低价态的只有还原性,中间价态的既有氧化性又有还原性.①Cl-处于最低价态,只有还原性; ②Fe2+ 处于中间价态,既有氧化性又有还原性; ③Fe3+处于最高价态只有氧化性; ④S最高价为+6价,最低为-2价,故S处于中间价态,既有氧化性又有还原性;⑤MnO4- 最高价为+7价,只有氧化性;⑥Ag+处于最高价,只有氧化性;⑦SO2硫元素为+4价,处于中间价态,既有氧化性又有还原性,故答案选C。
考点:氧化还原反应
本题难度:一般
4、选择题 利用右图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的是 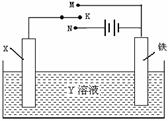
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
参考答案:D
本题解析:试题分析:A选项中锌的活泼性比铁强,所以可减缓铁的腐蚀,这种方法的名称也正确,所以A选项正确;B选项电解饱和NaOH溶液相当于电解水,NaOH饱和溶液的浓度不变,所以pH不变,所以B选项正确;C选项是原电池,铜是正极,质量将增加,铁是负极,此时外电路中的电子由负极向正极移动,C选项正确;D选项是在铁棒上镀铜,铁棒质量将增加,但溶液中各离子浓度都不发生变化,所以D选项错误。
考点:原电池和电解池
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断。电解中最关键的是准确判断出电极上离子的放电顺序。在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。
本题难度:简单
5、选择题 根据下列事实,判断离子的氧化性顺序为
①A?+?B2+?=?A2+?+?B?
②D?+?2H2O?=?D(OH)2+H2↑?
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2+?+?2e-=?E,B?-?2e-?=?B2+?
A.E2+>B2+>A2+>D2+
B.D2+>A2+>B2+>E2+
C.D2+>E2+> B2+>A2+
D.A2+>B2+>D2+>E2+
参考答案:A
本题解析:考查金属性强弱比较。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数例外)。
6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。
7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
8.依据电解池中阳离子的放电(得电子,氧化性)顺序。优先放电的阳离子,其元素的金属性弱。
所以正确的答案选A。
本题难度:困难