时间:2017-08-26 02:11:58
1、选择题 某温度下,0.1mol·L-1NaHCO3溶液pH=10,下列判断正确的是(?)
A.溶液中碳酸氢根电离的氢离子浓度为10-10mol·L-1
B.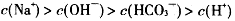
C.溶液中水电离的氢氧根离子浓度为10-4mol·L-1
D.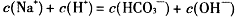
参考答案:C
本题解析:A项:碳酸氢根离子水解大于电离,才呈碱性,H+主要由水电离生成的,溶液中总的氢离子浓度为10-10mol·L-1,故错;B项:OH-离子是由水解生成的,浓度很小,故错;D项:溶液中负电荷还有CO32-,故错。故选C。
点评:本题考查的是水溶液中,各个离子之间浓度的关系,题目难度适中,注意基础知识的学习及应用。
本题难度:简单
2、选择题 关于常温下pH = 12的NaOH溶液,下列说法错误的是
A.c(OH-) =c(Na+) + c(H+)
B.由水电离出的c(OH-) = 1.0×10-12 mol·L-1
C.与等体积pH = 2的醋酸混合后所得溶液显碱性
D.与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+)> c(NH4+)
参考答案:C
本题解析:氢氧化钠、水都是电解质,二者都能电离,则氢氧化钠溶液含有钠离子、氢离子、氢氧根离子,溶液呈电中性,根据电荷守恒定律,则溶液中c(OH-)=c(Na+)+c(H+),故A正确;pH=12,则溶液中c(H+)=1.0×10-12 mol·L-1,由于溶液中的氢离子来自水的电离,氢氧化钠不能电离出氢离子,则水电离出的c(H+)=1.0×10-12 mol·L-1,由于H2O H++OH-中各物质的系数之比等于物质的量浓度之比,则由水电离出的c(OH-)= 水电离出的c(H+)=1.0×10-12 mol·L-1,故B正确;由于氢氧化钠溶液中c(OH-)=Kw/c(H+)=Kw/10-pH,醋酸溶液中c(H+)=10-pH mol·L-1,n=c?V,则混合前氢氧化钠溶液中氢氧根离子的物质的量等于醋酸溶液中氢离子的物质的量,氢氧化钠是强碱,完全电离,则酸碱混合后氢氧化钠溶液中氢氧根离子的物质的量不能增大,而醋酸是弱酸,部分电离,酸碱混合后促进醋酸的电离平衡向生成氢离子的方向移动,则醋酸溶液中氢离子的物质的量增大,所以氢离子过量、氢氧根离子不足,则混合溶液显酸性,故C错误;氢氧化钠溶液中c(OH-)=Kw/c(H+)=Kw/10-pH="0.01" mol·L-1,由于n=c?V,则混合前氢氧化钠的物质的量等于氯化铵的物质的量,因此二者恰好完全反应,生成等物质的量(或浓度)的氯化钠和一水合氨,即NaOH+NH4Cl=NaCl+NH3?H2O,由于氯化钠是强电解质、一水合氨是弱电解质,前者完全电离、后者部分电离,则混合后溶液中c(Na+)> c(NH4+),故D正确。
H++OH-中各物质的系数之比等于物质的量浓度之比,则由水电离出的c(OH-)= 水电离出的c(H+)=1.0×10-12 mol·L-1,故B正确;由于氢氧化钠溶液中c(OH-)=Kw/c(H+)=Kw/10-pH,醋酸溶液中c(H+)=10-pH mol·L-1,n=c?V,则混合前氢氧化钠溶液中氢氧根离子的物质的量等于醋酸溶液中氢离子的物质的量,氢氧化钠是强碱,完全电离,则酸碱混合后氢氧化钠溶液中氢氧根离子的物质的量不能增大,而醋酸是弱酸,部分电离,酸碱混合后促进醋酸的电离平衡向生成氢离子的方向移动,则醋酸溶液中氢离子的物质的量增大,所以氢离子过量、氢氧根离子不足,则混合溶液显酸性,故C错误;氢氧化钠溶液中c(OH-)=Kw/c(H+)=Kw/10-pH="0.01" mol·L-1,由于n=c?V,则混合前氢氧化钠的物质的量等于氯化铵的物质的量,因此二者恰好完全反应,生成等物质的量(或浓度)的氯化钠和一水合氨,即NaOH+NH4Cl=NaCl+NH3?H2O,由于氯化钠是强电解质、一水合氨是弱电解质,前者完全电离、后者部分电离,则混合后溶液中c(Na+)> c(NH4+),故D正确。
本题难度:简单
3、选择题 pH=2的强酸溶液,加水稀释,若溶液体积扩大10倍,则C(H+)或C(OH-)的变化
A.c(H+)和c(OH-)都减少
B.c(H+)增大
C.c(OH-)减小
D.c(H+)减小
参考答案:D
本题解析:稀释强酸,则氢离子的浓度降低。根据水的离子积常数可知,c(OH-)是增大的,答案选D。
本题难度:简单
4、选择题 MOH强碱溶液和等体积等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
A.c(M+)>c(OH-)>c(A-)>c(H+)
B.c(M+)> c(A-) > c(H+)> c(OH-)
C.c(M+)> c(A-) > c(OH-) >c(H+)
D.c(M+)> c(H+) >c(A-)> c(OH-)
参考答案:C
本题解析:根据题意可知,酸和碱的物质的量是相等的,二者恰好反应。但由于酸是弱酸,所以生成的盐水解,溶液显碱性,答案选C。
点评:在判断中和反应后溶液的酸碱性时,应该首先判断酸或碱的过量问题。只有当酸或碱恰好反应时,才能考虑生成的盐是否水解。
本题难度:一般
5、选择题 常温下pH 的CH3COOH稀溶液与pH
的CH3COOH稀溶液与pH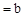 的NaOH稀溶液等体积混合,下列判断错误
的NaOH稀溶液等体积混合,下列判断错误
的是(?)
A.若混合后pH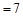 ,则
,则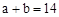
B.反应过程中,CH3COOH的电离度增大
C.若混合后pH ,则c
,则c <c
<c
D.若混合后CH3COOH与NaOH恰好完全反应,则
参考答案:AD
本题解析:A、若强酸与强碱等体积混合pH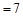 ,则
,则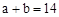 ;CH3COOH是弱酸,部分电离,a+b<14,错误;B由于CH3COOH不断与NaOH反应,被消耗,CH3COOH的电离度增大,正确;C、电荷守恒c
;CH3COOH是弱酸,部分电离,a+b<14,错误;B由于CH3COOH不断与NaOH反应,被消耗,CH3COOH的电离度增大,正确;C、电荷守恒c +c(H+)= c
+c(H+)= c +c(OH-)? pH
+c(OH-)? pH ,酸性,c(H+)>c(OH-),所以c
,酸性,c(H+)>c(OH-),所以c <c
<c ?,正确;D、CH3COOH与NaOH恰好完全反应,生成CH3COONa ,碱性,a+b >14,,错误.
?,正确;D、CH3COOH与NaOH恰好完全反应,生成CH3COONa ,碱性,a+b >14,,错误.
本题难度:一般