时间:2017-08-26 02:09:44
1、实验题 实验室欲用NaOH 固体配制1.0 mol/L的NaOH溶液240 mL
(1)配制溶液时,一般可以分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动 其正确的操作顺序为_________(填编号)。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、_____________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为____g,要完成本实验该同学应称出____g NaOH。 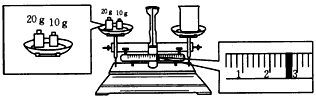
(3)使用容量瓶前必须进行的一步操作是_____________________
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是____。
A.转移溶液时有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
参考答案:(1)②①③⑧⑤⑥⑨⑦④;250mL容量瓶
(2)27.4;10
(3)查漏
(4)BC
本题解析:
本题难度:一般
2、选择题 配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的是
[? ]
A.所用NaOH已经潮解
B.向容量瓶加水时液面低于刻度线即摇匀
C.有少量NaOH溶液残留在烧杯内
D.向容量瓶加水时眼睛一直俯视液面
参考答案:BD
本题解析:
本题难度:一般
3、填空题 实验一:称量9.5g?MgCl2溶于水配成100mL溶液;
实验二:取“实验一”配得的Mg?Cl2溶液25.0mL,稀释到500mL.
(1)“实验一”所得MgCl2溶液的物质的量浓度为______,“实验二”所得Mg?Cl2溶液中Cl-的物质的量浓度为______.
(2)以上两个实验中除了用烧杯、量筒、胶头滴管外,还需要用到的玻璃仪器为______.
(3)配制“实验一”的溶液时,以下几个步骤:①量取;②计算;③溶解;④摇匀;⑤转移;⑥洗涤;⑦定容;⑧冷却.其正确操作顺序为______(填序号).
(4)“实验二”中下列操作可引起所配溶液浓度偏高的有______(填序号).
①洗涤量取MgCl2溶液的量筒,并将洗涤液转移到容量瓶中;
②量取MgCl2溶液时,俯视刻度线;
③转移前,容量瓶中含有少量蒸馏水;
④未洗涤稀释MgCl2溶液时用过的烧杯和玻璃棒;
⑤定容时,俯视刻度线.
参考答案:(1)9.5g?MgCl2 的物质的量n=mM=9.5g95g/mol=0.1mol,配成100mL溶液根据公式C=nV=0.1mol0.1L=1mol/L;实验二:取“实验一”配得的Mg?Cl2溶液25.0mL,稀释到500mL,也就是将原溶液稀释20倍,所以,此时MgCl2的浓度为
1mol/L20=0.05mol/L,所得Mg?Cl2溶液中Cl-的物质的量浓度为MgCl2浓度的两倍,0.1mol/L,
故答案为:1mol/L;0.1mol/L;
(2)配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般天平称量固体,把氯化镁倒入烧杯进行溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,配成100mL溶液,实验二:取“实验一”配得的Mg?Cl2溶液25.0mL,稀释到500mL,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、100mL容量瓶、500mL容量瓶,所以还需要100mL容量瓶、500mL容量瓶;玻璃棒,
故答案为:100mL容量瓶;500mL容量瓶;玻璃棒;
(3)配制一定物质的量浓度的溶液的基本步骤:计算、量取、溶解、移液、洗涤、定容、摇匀、装瓶存放等操作.据此可得配制“实验一”的溶液正确操作顺序,故答案为:②①③⑧⑤⑥⑦④;
(4)根据公式C=nV计算分析,不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高.
①洗涤量取MgCl2溶液的量筒,并将洗涤液转移到容量瓶中;量筒在设计时就考虑了不洗涤带来的误差,所以,洗涤量筒只能使配制的浓度偏大,故①正确;
②量取MgCl2溶液时,俯视刻度线;用量筒量取液体时,俯视读数,使所读液体的体积偏小,能使配制的浓度偏小,故②错误;
③转移前,容量瓶中含有少量蒸馏水;容量瓶中有少量水,转移溶液前将容量瓶烘干,对溶质的物质的量、溶液的体积无影响,所以不会造成所配溶液浓度偏高,故③错误;
④未洗涤稀释MgCl2溶液时用过的烧杯和玻璃棒;溶质没有全部转移到容量瓶中,使配制的浓度偏小,故④错误;
⑤定容时,俯视刻度线.定容时俯视容量瓶瓶颈刻度线,会导致溶液的体积偏小,所配制溶液浓度偏高,故⑤正确;故选①⑤;
本题解析:
本题难度:一般
4、选择题 配制100 mL 1.0 mol/L Na2CO3溶液,下列操作正确的是
[? ]
A.称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
参考答案:D
本题解析:
本题难度:简单
5、选择题 要配制物质的量浓度为2mol?L-1?CuSO4溶液90mL,下面的操作正确的是( )
A.称取45gCuSO4?5H2O固体,放入250mL烧杯中,用100mL量筒量取90mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取32gCuSO4固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取32gCuSO4固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.称取50gCuSO4?5H2O放入100mL烧杯中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后转移入容量瓶中加蒸馏水至100mL,盖好瓶塞,反复摇匀
参考答案:A、45gCuSO4?5H2O固体的物质的量为0.18mol,溶于90ml水中硫酸铜溶液的浓度约是2mol/L,溶液体积为90ml,不是溶剂的体积为90ml,故A错误;
B、量筒只能用来量取液体,不能用来溶解固体,故B错误;
C、容量瓶只能用来配制溶液,不能用来稀释或溶解药品,故C错误;
D、没有90ml规格容量瓶,应选择100ml规格容量瓶,需CuSO4?5H2O质量为0.1L×2mol/L×250g/mol=50g,操作为称取90gCuSO4?5H2O放入烧杯中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后,转移入容量瓶中加蒸馏水至100mL,盖好瓶塞,反复摇匀,故D正确.
故选D.
本题解析:
本题难度:简单