时间:2017-08-26 01:46:36
1、选择题 在溶液中不能发生水解的离子是
A.HS-
B.CO32-
C.Fe3+
D.Br-
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列溶液中各微粒的浓度关系正确的是
A.pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液,NH4+大小顺序为①>②>③
B.pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
C.0.2 mol·L-1的Na2CO3溶液: c(OH-)=c(HCO3—)+c(H+)+c(H2CO3)
D.0.2 mol·L-1 HCl与0.1 mol·L-1 NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)
参考答案:D
本题解析:A.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,NH4HSO4电离出H+,NH4+浓度最小,NH4Cl和(NH4)2SO4水解程度相同,则c(NH4+)相同,正确顺序为①=②>③,错误;B.由于酸性HF>CH3COOH,所以等pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)],错误;C.0.2 mol·L-1的Na2CO3溶液:根据质子守恒可得: c(OH-)=c(HCO3—)+c(H+)+2c(H2CO3),错误;D.0.2 mol·L-1 HCl与0.1 mol·L-1 NaAlO2溶液等体积混合,得到的是NaCl、AlCl3的混合溶液。而且物质的量n(NaCl)>n(AlCl3),由于NaCl是强酸强碱盐不水解,AlCl3是强酸弱碱盐,水解使溶液显酸性,所以c(H+)>c(OH-),但是盐水解的程度是微弱的,所以根据物料守恒可得:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),正确。
考点:考查离子浓度的大小比较的知识。
本题难度:困难
3、选择题 50℃时,0.1mol·L-1Na2CO3溶液pH=12,下列判断正确的是
A.c(OH-)=10-2mol·L-1
B.加入少量NaOH固体,c(Na+)和c(CO32-)均增大
C.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
D.2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
参考答案:B
本题解析:A、因为50℃时,Kw未知,则pH=12,只能说明氢离子浓度为10-12mol/L,则氢氧根离子浓度无法计算,错误;B、碳酸钠溶液中,存在CO32-+H2O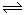 HCO3-+OH-,加入少量NaOH固体,氢氧根离子浓度增大,水解平衡逆向移动,c(Na+)和c(CO32-)均增大,正确;C、根据电荷守恒,则c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),错误;D、根据物料守恒,则c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),错误,答案选B。
HCO3-+OH-,加入少量NaOH固体,氢氧根离子浓度增大,水解平衡逆向移动,c(Na+)和c(CO32-)均增大,正确;C、根据电荷守恒,则c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),错误;D、根据物料守恒,则c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),错误,答案选B。
考点:考查电解质溶液中离子浓度的判断,水解平衡移动、溶液中离子浓度大小比较的知识。
本题难度:一般
4、选择题 归纳法是
参考答案:
本题解析:
本题难度:困难
5、简答题 (10分)(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,设由水电离产生的OH-的物质的量浓度分别为A和B,则A________B(填“>”、“=”或“<”)。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若向该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_________________________,其原因是_________________________。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是_______________。
②若为弱酸强碱盐,其第一步水解的离子方程式是___________________________。
参考答案:(10分)(1);<
(2)产生白色沉淀,红色逐渐褪去(两个现象各1分,意思对就给分);
钡离子与碳酸根离子结合成为难溶的碳酸钡,从而抑制了碳酸根离子的水解。(意思对就给分)
(3)An++nH2O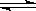 A (OH)n+nH+ Bm-+H2O
A (OH)n+nH+ Bm-+H2O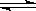 HB (m-1)- + OH-
HB (m-1)- + OH-
本题解析:(1)氢氧化钠溶液中,存在大量的氢氧根离子,对水的电离起抑制作用,而醋酸钠溶液中,醋酸根离子水解,对水的电离起促进作用,所以水电离产生的氢氧根离子的浓度A<B;
(2)纯碱为碳酸钠,因为碳酸根离子水解使溶液呈碱性,所以加入酚酞试液变红色,再滴入氯化钡溶液,因为钡离子与碳酸根离子结合为碳酸钡沉淀,使碳酸根离子的浓度减小,碳酸根离子的水解平衡逆向移动,溶液的碱性减弱,所以红色逐渐褪去,且产生白色沉淀;
(3)对于强酸弱碱盐水解时,弱碱的阳离子水解的离子方程式一步写成,所以水解的离子方程式是An++nH2O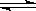 A (OH)n+nH+;对于弱酸强碱盐水解时,弱酸根离子的水解是分步写的,所以第一步水解的离子方程式是Bm-+H2O
A (OH)n+nH+;对于弱酸强碱盐水解时,弱酸根离子的水解是分步写的,所以第一步水解的离子方程式是Bm-+H2O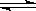 HB (m-1)-+OH-。
HB (m-1)-+OH-。
考点:考查条件对水电离的影响,水解离子方程式的书写
本题难度:困难