时间:2017-08-26 01:46:36
1、填空题 (12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度 (mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
 c(Na+)离子浓度的大小关系是 (填序号)。A.前者大 B.后者大 C.一样大 D.无法判断
c(Na+)离子浓度的大小关系是 (填序号)。A.前者大 B.后者大 C.一样大 D.无法判断参考答案: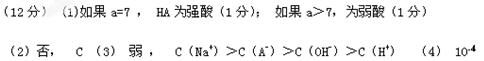
本题解析:略
本题难度:困难
2、选择题 常温下,将a mol/L的MOH(可溶性弱碱)与b mol/L盐酸等体积混合,已知相同条件下MOH的电离程度大于M+的水解程度,则下列有关推论不正确的是( )
A.若混合后溶液pH=7,则c(M+)=c(Cl-)
B.若b=2a,则c(Cl-)>c(M+)>c(H+)>c(OH-)
C.若a=2b,则c(M+)>c(Cl-)>c(OH-)>c(H+)
D.若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b
参考答案:B
本题解析:根据溶液的电中性原理可知A项正确;若b=2a,混合后的溶液为等物质的量浓度的MCl和HCl的混合溶液,M+离子部分水解,故c(H+)>c(M+),B项错误;若a=2b,混合后的溶液为等物质的量浓度的MCl和MOH的混合溶液,因MOH的电离程度大于M+的水解程度,故c(OH-)>c(H+),MOH的电离是微弱的,故c(Cl-)>c(OH-),C项正确;若b=a,混合后的溶液为MCl溶液,根据质子守恒可知c(H+)=c(OH-)+c(MOH),D项正确
本题难度:一般
3、填空题 (10分)
(1)制备氢氧化铁胶体的化学方程式为 。
(2)碳酸氢钠在水溶液中的电离方程式为 。
(3)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是 (填选项字母)。
HSO3-+OH-水解平衡的事实是 (填选项字母)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)现有可逆反应:2A(g)+2B(g) C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
A.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同
B.达到平衡时,途径Ⅱ所得混合气密度为途径Ⅰ所得混合气密度的2倍
C.达到平衡时,途径ⅡC的平衡浓度大于途径ⅠC的平衡浓度的2倍
(5)在恒容绝热(不与外界交换能量)条件下进行2A (g)+ B(g) 2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系: 。
2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系: 。
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
参考答案:(1) FeCl3 + 3H2O  Fe(OH)3 (胶体)+ 3HCl (2分)
Fe(OH)3 (胶体)+ 3HCl (2分)
(2) NaHCO3 = Na+ + HCO3 - (2分)
(3)C (2分)
(4) C (2分)
(5)K随温度的升高而减小(2分)
本题解析:(1)氯化铁在沸水中水解制备胶体,制备反应为FeCl3+3H2O Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
(2)碳酸氢钠为强电解质,在水溶液中的电离方程式为NaHCO3=Na++HCO3-。
(3)A、滴入酚酞溶液变红,再加入H2SO4溶液后反应生成硫酸钠、水和二氧化硫,不能确定水解平衡的存在,错误;B、滴入酚酞溶液变红,再加入氯水后,发生氧化还原反应,生成硫酸钠,且氯水中HClO具有漂白性,不能确定水解平衡的存在,错误;C、滴入酚酞溶液变红,再加入BaCl2溶液后,SO32-+H2O?HSO3-+OH-水解平衡逆向移动,产生沉淀且红色褪去,正确。
(4)在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ.A、B的起始物质的量均为2mol,Ⅱ.C、D的起始物质的量分别为2mol和6mol,对于途径II极性转化为A、B,A、B的起始物质的量均为4mol,二者为等效平衡,但D为固体,II中压强大,平衡正向移动,则A、Ⅰ、Ⅱ两条途径最终达到的平衡为等效平衡,II中压强大,平衡正向移动的趋势大,则体系内各混合气体的百分组成不相同,错误;B、达到平衡时,D为固体,Ⅱ中气体的总质量小于Ⅰ的2倍,而容器容积相同,即途径Ⅱ所得混合气密度小于途径Ⅰ所得混合气密度的2倍,错误;C、达到平衡时,两个平衡为等效平衡,由于Ⅱ中初始反应物为Ⅰ的2倍,II中压强大,生成C大于I中额的2倍,且容器容积相同,达到平衡时,途径ⅡC的平衡浓度大于途径ⅠC的平衡浓度的2倍,正确。
(5)由起始D的物质的量为0可知,反应2A (g)+B(g)?2C(g)+D(s)向正反应进行建立平衡,正反应是气体体积减小的反应,容器的体积不变,平衡时压强增大,故绝热条件下,混合气体的温度升高,即正反应为放热反应,升高温度平衡向逆反应进行,化学平衡常数减小。
考点:本题考查化学平衡的判断和移动、方程式的书写、等效平衡、化学平衡常数。
本题难度:一般
4、选择题 人们把能对抗外来少量酸、碱或稍加稀释而引起溶液pH发生明显变化的作用叫做缓冲作用,具有缓冲作用的溶液叫缓冲溶液.缓冲溶液往往由弱酸与其对应的盐、多元弱酸与其对应的次级盐、弱减与其对应的盐组成.下列各组溶液不能形成缓冲溶液的是
A.CH3COOH与CH3COONa形成的溶液
B.NaHCO3与Na2CO3形成的溶液
C.Na2SO4与H2SO4形成的溶液
D.NH3·H2O与NH4Cl形成的溶液
参考答案:C
本题解析:
本题难度:一般
5、选择题 Na2CO3水溶液中存在CO2-3+H2O HCO-3+OH-平衡。下列说法不正确的是
HCO-3+OH-平衡。下列说法不正确的是
A.稀释溶液,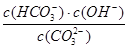 增大
增大
B.通入CO2,溶液pH减小
C.升高温度,此平衡常数增大
D.加入NaOH固体, 减小
减小
参考答案:A
本题解析:A、稀释溶液,水解平衡向左移动,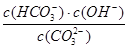 减小,A错误;B、通入CO2,由于H2CO3
减小,A错误;B、通入CO2,由于H2CO3 HCO-3+H+,溶液pH减小,B正确;C、水解是吸热过程,升高温度,此平衡常数增大,C正确;D、加入NaOH固体,CO2-3+H2O
HCO-3+H+,溶液pH减小,B正确;C、水解是吸热过程,升高温度,此平衡常数增大,C正确;D、加入NaOH固体,CO2-3+H2O HCO-3+OH-平衡向左移动,
HCO-3+OH-平衡向左移动, 减小,D正确;答案选A。
减小,D正确;答案选A。
考点:盐的水解平衡
本题难度:一般