时间:2017-08-26 01:41:07
1、简答题 浓硫酸和碳反应的化学方程式为C+2H2SO4(浓)
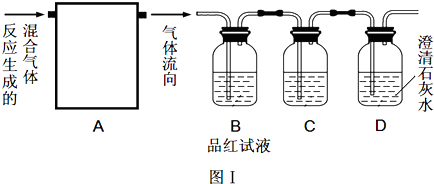
参考答案:(1)依据碳和浓硫酸加热反应生成的产物为二氧化碳、二氧化硫和水蒸气,验证全部产物需要先用无水硫酸铜验证水蒸气的存在,防止后续实验通过溶液带出的水蒸气干扰;
故答案为:③;
(2)依据碳和浓硫酸加热反应生成的产物为二氧化碳、二氧化硫和水蒸气,验证全部产物需要先用无水硫酸铜雁阵水蒸气的存在,再利用品红验证二氧化硫气体存在,通过高锰酸钾除去二氧化硫,通过品红验证二氧化硫是否除尽,最后通过澄清石灰水验证二氧化碳气体的存在;
故答案为:水蒸气、SO2、CO2;
(3)先除去二氧化硫,再最后通过澄清石灰水验证二氧化碳气体的存在,防止二氧化硫对二氧化碳检验的干扰;
故答案为:澄清石灰水变浑浊;
(4)C装置中盛有足量的酸性高锰酸钾溶液是除去二氧化硫气体;
故答案为:除去SO2;
(5)①在C、D之间再接一个B装置验证二氧化硫是否除净,防止二氧化硫对二氧化碳检验的干扰;
故答案为:验证SO2已除干净;
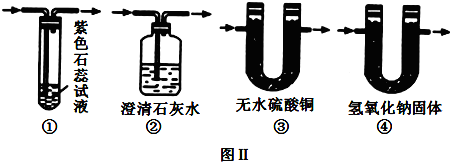
②装置D后为排除空气中 的二氧化碳对实验的干扰需要选择②④;
故答案为:②④;
本题解析:
本题难度:简单
2、填空题 以黄铁矿为原料生产硫酸的工艺流程图如下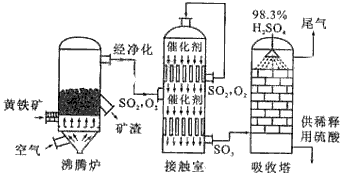
(1)将燃烧黄铁矿的化学方程式补充完整4_______+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是_________________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)_______________。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高的SO2反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160gSO3气体与H2O化合放出260.6kJ的热量,该反应的热化学方程是__________________________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是__________________________。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果:铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是________%; 若铵盐质量为15.00g。
浓硫酸增加的质量为__________。 (计算结果保留两位小数)
参考答案:(1)FeS2
(2)2SO2+O2 2SO3
2SO3
(3)abd
(4)SO3(g)+H2O(l)==H2SO4(l);△H=-130.3kg/mol
(5)①SO2+Br2+2H2O==4H++2Br-+SO42-;②14.56;2.31g
本题解析:
本题难度:困难
3、选择题 被誉为“百年新药”的阿司匹林的有效成分是乙酰水杨酸,其结构简式如图所示,下列关于乙酰水杨酸的说法中,不正确的是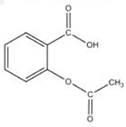
A.可用于治疗胃酸过多
B.分子式为C9H8O4
C.能与乙醇发生酯化反应
D.能与H2发生加成反应
参考答案:A
本题解析:A错,阿司匹林为镇痛解热药物功能且分子结构中含有—COOH为酸性基团,不可用于治疗胃酸过多;
本题难度:一般
4、选择题 将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在的条件下与1 mol乙酸充分反应,下列叙述不正确的是(?)
A.生成的乙酸乙酯中含有18O
B.生成的水分中含有18O
C.可能生成88 g乙酸乙酯
D.不可能生成88 g乙酸乙酯
参考答案:BC
本题解析:酯化反应的实质是“酸脱羟基、醇脱氢”,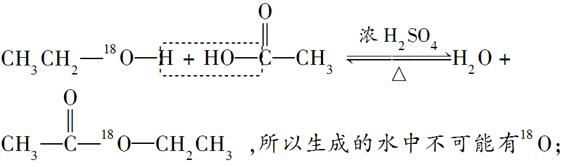
根据酯化反应的化学方程式知,1 mol乙醇理论上可生成1 mol乙酸乙酯,即88 g,由于酯化反应是可逆反应,不能进行到底,因此,实际上不可能得到88 g乙酸乙酯。
本题难度:一般
5、简答题 某研究性小组对浓硫酸和稀硫酸的鉴别进行了科学探究,他们设计的四种探究方案如下:
| 方案 | 实验方法 | 结论 甲 分别将两种酸加入蔗糖中 变黑,体积膨胀者为浓硫酸 乙 将铁片分别加入两种酸中 产生刺激性气味的为浓硫酸 丙 分别将两种酸加入水中 放热的为浓硫酸 丁 分别把两种酸滴在蓝色石蕊试纸上 变红的为浓硫酸 |
参考答案:方案甲:分别将两种酸加入蔗糖中,由于浓硫酸具有脱水性和强氧化性,则蔗糖变黑,并生成二氧化硫和二氧化碳气体,体积膨胀,故甲实验方法和结论都正确;
方案乙:将铁片分别加入两种酸中,浓硫酸与铁发生钝化反应,没有明显现象,稀硫酸与铁反应生成无色无味气体,则该方案实验方法正确,结论错误;
方案丙:分别将两种酸加入水中,浓硫酸溶于水放热,稀硫酸无明显现象,则方案丙中实验方法和结论都正确;
方案丁:浓硫酸和稀硫酸都具有酸性,都能使蓝色石蕊试纸变红,则该方案实验方法和结论都错误.
故答案为:(1)甲、丙;?
(2)乙;产生无色无味气体的是稀硫酸或无明显现象的是浓硫酸;
(3)丁;因为浓硫酸和稀硫酸都能使蓝色石蕊试纸变红.
本题解析:
本题难度:一般