时间:2017-08-26 01:15:54
1、填空题 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1) 实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则甲醇的标准燃烧热△H= _______。
(2)今有如下两个热化学方程式:则a ____b(填“>”、“=“<”)
? H2(g)+ O2(g)=H2O(g);△H1=a kJ·mol-1?
? ? H2(g)+ O2(g)=H2O(l);△H2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。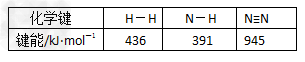
已知反应N2(g)+3H2(g) 2NH3(g) ;△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________(注明“+“-”)。
2NH3(g) ;△H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________(注明“+“-”)。
(4 )依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);△H =-90.8 kJ·mol-1
CH3OH(g);△H =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);△H=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);△H=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);△H=-41.3 kJ·mol-1
CO2(g) + H2(g);△H=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的△H=____________。
CH3OCH3(g) + CO2 (g)的△H=____________。
2、选择题 已知:H2(g)+1/2O2(g)==H2O(l) ΔH=-285.8 kJ·mol-1 CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH=-890kJ·mol-1 现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比为
[? ]
3、选择题 C、CO、CH4、C2H5OH是常用的燃料,它们每1 mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5 kJ、110.5 kJ、890.3 kJ、1 366.8 kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是
[? ]
A、C
B、CO
C、CH4
D、C2H5OH
4、选择题 下列对反应热的描述,不正确的是
A.热化学方程式中的化学计量数仅表示该物质的物质的量
B.凡是放热反应发生时都不需加热
C.化学反应一般都伴随着能量的变化
D.吸热反应中反应物的总能量低于生成物的总能量
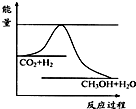
5、简答题 温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
(1)关于该反应的下列说法中,正确的是______.
A.△H>0,△S>0;B.△H>0,△S<0;
C.△H<0,△S<0;D.△H<0,△S>0.
(2)该反应平衡常数K的表达式为______.
(3)温度降低,平衡常数K______(填“增大”、“不变”或“减小”).
(4)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)______mol?L-1?min-1.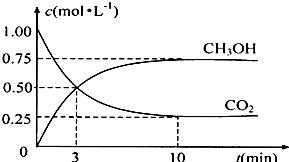
(5)下列措施中能使
| n(CH3OH) n(CO2) |