时间:2017-08-26 01:07:03
1、选择题 为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找能源,以下做法不能提高燃料效率的是(?)
A.煤的汽化与液化
B.液体燃料呈雾状喷出
C.通入大大过量的空气
D.将煤粉粉碎
参考答案:C
本题解析:可燃物在燃烧时,如果通入大大过量的空气,则会造成热量的损失,不能提高燃料效率,其余选项都是可以的,答案选C。
点评:该题是常识性知识的考查,试题贴近生活实际,有利于调动学生的学习兴趣和学习积极性,有利于提高学生的能源节约意识,难度不大。
本题难度:简单
2、选择题 水的电离平衡曲线如图所示,下列说法不正确的是?(?)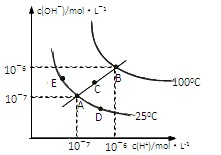
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl 固体的变化
参考答案:C
本题解析:根据图像可知,ADE三点的温度相同,都小于C点,C点小于B点。由于电离是吸热的,所以水的离子积常数随温度的升高而增大,A正确,D不正确。从A→D,氢离子浓度增大,所以在温度不变时,加入酸即可,B正确。B点根据图像可知,水的离子积常数是1×10-12,所以pH=10的KOH溶液的浓度是0.01mol/L,因此酸和碱恰好反应,溶液显中性,C正确。答案选D。
本题难度:一般
3、选择题 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是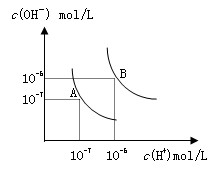
A.纯水中25℃时的c(H+)比100℃时的c(H+)大
B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D.25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
参考答案:D
本题解析:A、水的电离为吸热反应,升高温度,水的电离程度增大,氢离子浓度增大,所以纯水中25°C时的c(H+)比100℃的时c(H+)小,错误;B、根据题给图像知,100℃时水的离子积为10-12,由水电离产生的c(H+)=1×10-11mol?L-1,若溶液为酸性溶液,氢离子浓度为:0.1mol/L,溶液的pH=1;若溶液为碱性溶液,则溶液中氢离子浓度为1×10-11mol?L-1,溶液pH=11,错误;C、100℃时水的离子积为10-12,混合溶液的pH=7,反应后的溶液为碱性溶液,溶液中氢离子浓度为1×10-7mol?L-1,氢氧根离子浓度为1×10-5mol?L-1; pH=9的Ba(OH)2溶液中氢氧根离子浓度为1×10-3mol?L-1,与pH=4的稀盐中氢离子浓度为1×10-4mol?L-1,设氢氧化钡的体积为x,盐酸溶液的晶体为y,则:(10?3x?10?4y)/(x+y) =1×10-5,解得x:y=1:10,错误;D、25℃时,氢离子浓度为1.0×10-7mol/L,钠离子浓度为1.0×10-3mol/L,则溶液中c(Na+):c(OH-)=1.0×10-3mol/L:1.0×10-7mol/L=104:1,正确。
本题难度:一般
4、选择题 在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为
A.C2H6(g) + 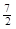 O2(g)=2CO2(g) +3H2O(l)△H =-1560kJ·mol-1
O2(g)=2CO2(g) +3H2O(l)△H =-1560kJ·mol-1
B.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(g)△H =-1560kJ·mol-1
C.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(l)△H =+3120 kJ·mol-1
D.C2H6(g) +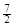 O2(g)=2CO2(g) +3H2O(l)△H =-52.0kJ·mol-1
O2(g)=2CO2(g) +3H2O(l)△H =-52.0kJ·mol-1
参考答案:A
本题解析:乙烷燃烧属于放热反应,△H<0,则C项错误;根据“1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ”得“1.0mol乙烷气体完全燃烧生成液态水时放出热量52×30=1560kJ”,则A项正确,B、D项错误。
本题难度:一般
5、选择题 下列说法正确的是
A.已知 则可以计算CH3—CH3 → CH2=CH2+H2;ΔH =+125.6 kJ/mol
则可以计算CH3—CH3 → CH2=CH2+H2;ΔH =+125.6 kJ/mol
B.能说明NH3结合H+能力比H2O强:NH3+H3O+=NH+4+H2O
C.已知下列热化学方程式:2H2(g)+O2(g) ="==" 2H2O(g) △H=-484kJ/mol,则氢气的燃烧热为-242kJ/mol
D.已知中和热为-57.4kJ/mol ,则NaOH(aq) +CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H =-57.4kJ/mol
参考答案:B
本题解析:A、根据反应热等于反应物的键能之和减去生成物的键能之和,则CH3-CH3→CH2=CH2+H2的△H="+728.3" kJ/mol,错误;B、由反应NH3+H3O+=NH4++H2O知,氨分子能夺取水合氢离子中的氢离子,说明NH3结合H+能力比H2O强,正确;C、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,水的状态应为液态水,错误。D、中和热-57.4kJ/mol的适用条件为:稀溶液、强酸与强碱反应、生成1mol水,则NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)反应过程中多一个醋酸电离的吸热过程,△H >-57.4kJ/mol,错误。
考点:考查反应热的计算,燃烧热、中和热的概念。
本题难度:一般