时间:2017-08-26 01:07:03
1、选择题 用0.01 mol/L? H2SO4滴定0.01mol/L NaOH溶液,中和后加水至100ml,若滴定时终点判断有误差:①多加1滴H2SO4;②少加1滴H2SO4;(设1滴为0.05ml)则①和②c(H+)的比值是
A.10
B.50
C.5×103
D.104
参考答案:D
本题解析:多加1滴硫酸,则溶液中氢离子的浓度为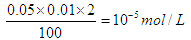 。同样少加1滴硫酸,溶液中OH-的浓度就应该是10-5mol/L,则①和②c(H+)的比值是104。答案选D。
。同样少加1滴硫酸,溶液中OH-的浓度就应该是10-5mol/L,则①和②c(H+)的比值是104。答案选D。
本题难度:一般
2、选择题 已知水的电离方程式:H2O H++OH-,下列叙述中正确的是
H++OH-,下列叙述中正确的是
A.升高温度,KW增大,pH不变
B.向水中加入少量稀硫酸,c(H+)增大,KW不变
C.向水中加入氨水,平衡逆向移动,c(OH-)降低
D.向水中加入少量同体CH3COONa,平衡逆向移动,c (H+)降低
参考答案:B
本题解析:
正确答案:B
A.不正确,升高温度,KW增大,pH变小
B.正确, KW受温度影响。
C.不正确,向水中加入氨水,平衡逆向移动,但氨水电离出OH― ,c(OH-)增加。
D.不正确,向水中加入少量同体CH3COONa,CH3COO-与H+ 结合,水电离平衡正向移动,c (H+)降低。
本题难度:一般
3、填空题 某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)______25℃,理由是_________________________________________________,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合溶液为中性,则a:b=_________;
(2)若所得混合溶液pH=2,则a:b=__________。
参考答案:大于(1分);水的电离吸热,升高温度,促进水的电离,KW增大 (1分)(1)10:1 (2)9:2(每空2分)
本题解析:略
本题难度:简单
4、选择题 常温下,强酸溶液A和强碱溶液B的pH之和为15,当它们按一定体积比混合时,溶液的pH恰好等于7,则A与B的体积比是( ?)
A? 1︰10?B 10︰1? C 1︰100?D 100︰1?
参考答案:B
本题解析:常温下,强酸溶液A和强碱溶液B的pH之和为15,可以得到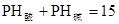 ,带入PH的计算公式可以得到
,带入PH的计算公式可以得到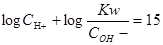 ,整理得到
,整理得到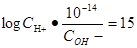 ,
, ,
,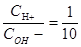 ,要使反应后溶液的PH=7,那么H+和OH-恰好完全反应,二者的物质的量之比为1:1,当物质的量确定是浓度和体积成反比,根据浓度之比为1:10,所以体积之比为10:1,答案选B.
,要使反应后溶液的PH=7,那么H+和OH-恰好完全反应,二者的物质的量之比为1:1,当物质的量确定是浓度和体积成反比,根据浓度之比为1:10,所以体积之比为10:1,答案选B.
本题难度:一般
5、填空题 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式 。?
(2)判断滴定终点的方法是 。?
(3)计算:血液中含钙离子的浓度为 g·mL-1。?
参考答案:(1)2Mn+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
(2)当滴入1滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色
(3)1.0×10-4
本题解析:因为滴加酸性KMnO4溶液至反应完毕过量时,会使溶液呈紫色,故可用滴入一滴酸性KMnO4溶液由无色变为浅紫色且半分钟不褪色的方法来判断终点。由题意知可能发生反应的离子方程式为:2Mn+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O、Ca2++C2
2Mn2++10CO2↑+8H2O、Ca2++C2 CaC2O4↓、CaC2O4+2H+
CaC2O4↓、CaC2O4+2H+ Ca2++H2C2O4。
Ca2++H2C2O4。
设2 mL血液中含Ca2+的物质的量为x,则
5Ca2+~5CaC2O4~5H2C2O4~2Mn
5 2
x 20.0×10-3 L×1.0×10-4 mol·L-1
x=5.0×10-6 mol,1 mL血液中Ca2+的浓度为=1.0×10-4 g·mL-1。
本题难度:一般