时间:2017-08-26 00:57:47
1、选择题 把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉质量相等,则原溶液中H+和SO42-的物质的量之比为
A.1∶4
B.2∶7
C.1∶2
D.8∶31
参考答案:A
本题解析:投入铁粉后发生的反应为Fe+2H+=Fe2++H2↑、Fe+Cu2+=Fe2++Cu,由于残余固体的质量与原来加入的铁粉质量相等,因此置换出的铜和参加反应的铁的质量是相同的。若设置换出了xmol铜,则和铜离子反应的铁是xmol,则与氢离子反应的铁是 。根据原子守恒可知硫酸和硫酸铜的物质的量分别就是
。根据原子守恒可知硫酸和硫酸铜的物质的量分别就是 和xmol,所以原溶液中H+和SO42-的物质的量之比为
和xmol,所以原溶液中H+和SO42-的物质的量之比为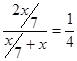 。所以答案是A。
。所以答案是A。
本题难度:一般
2、选择题 下列各组物质反应后,再滴入KSCN溶液,显红色的是
A.过量铁和稀盐酸
B.FeCl2溶液和氯水
C.过量铁和CuCl2溶液
D.过量铁和FeCl3溶液
参考答案:B
本题解析:
正确答案:B
A、Fe+2HCl=FeCl2+H2↑无Fe3+ 产生;
B. FeCl2溶液和氯水,2Fe2++Cl2=2Fe3++2Cl―有Fe3+产生
C.过量铁和CuCl2溶液:Fe+Cu2+=Fe2+Cu无Fe3+ 产生;
D.过量铁和FeCl3溶液?:2Fe3++Fe=3Fe2+?无Fe3+ 产生;
本题难度:简单
3、简答题 针对苏教版化学1第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”.请你参与探究并回答有关问题:
(1)利用KSCN、H2O2等药品检验反应后的混合液中含有二价铁的实验方法和现象是______;但在实验中往往又看到红色迅速褪去,同时溶液呈黄色,其可能的原因是______;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出该现象产生的化学方程式:______.
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色.若再滴加过量新制氯水,却发现红色褪去.同学对红色褪去的原因提出各自的假设.某同学的假设是:溶液中的+3价铁被氧化为更高的价态.”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式______.
(3)探究高铁酸钾的某种性质.
【实验一】将适量K2FeO4固体分别溶解于pH?为?4.74、7.00、11.50?的水溶液中,配得FeO42-浓度为?1.0mmol?L-1(1mmol?L-1=10-3mol?L-1)的试样,静置,考察不同初始?pH?的水溶液对K2FeO4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变).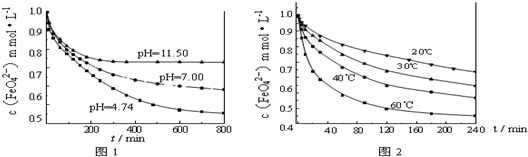

【试验二】将适量?K2FeO4溶解于pH=4.74?的水溶液中,配制成FeO42-浓度为?1.0mmol?L-1?的试样,将试样分别置于?20℃、30℃、40℃和?60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2.则
①实验1的目的是______;
②实验2可得出的结论是______;
③高铁酸钾在水中的反应为4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是______.
参考答案:(1)因亚铁离子具有还原性,铁离子遇KSCN溶液显血红色,则KSCN、H2O2等药品检验反应后的混合液中含有二价铁的实验方法和现象是先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈血红色;在实验中往往又看到红色迅速褪去,同时溶液呈黄色,其可能的原因是硫氰根被氧化;做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,发生2H2O2?FeCl3?.?2H2O+O2↑,
故答案为:先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈血红色;硫氰根被氧化;2H2O2?FeCl3?.?2H2O+O2↑;
(2)由信息可知,铁离子被氯气氧化为FeO42-和盐酸,该离子反应为2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+,
故答案为:2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+;
(3)①由实验一可知,pH不同,FeO42-稳定性不同,则实验1的目的为研究FeO42-在不同pH溶液中的稳定性(或反应的速率),
故答案为:研究FeO42-在不同pH溶液中的稳定性(或反应的速率);
②由图2可知,温度不同,FeO42-稳定性不同,所以实验2可得出的结论是温度越高,FeO42-越不稳定(或与水反应的速率越快),
故答案为:温度越高,FeO42-越不稳定(或与水反应的速率越快);
③由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,因pH=11.50的溶液中OH-离子浓度大,使4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑平衡向左移动,
故答案为:pH=11.50的溶液中OH-离子浓度大,使平衡向左移动.
本题解析:
本题难度:一般
4、选择题 将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是
A.硫酸
B.氯水
C.硝酸锌
D.溴水
参考答案:A
本题解析:铁屑溶于过量盐酸后上层氯化亚铁,稀硫酸和氯化亚铁不反应;氯水能把氯化亚铁氧化上层氯化铁;在酸性条件下,硝酸盐具有强氧化性,即硝酸锌能把氯化亚铁氧化,生成铁离子;另外溴水也具有强氧化性,能把亚铁离子氧化生成铁离子,所以正确的答案选A。
点评:该题是中等难度的试题,试题贴近高考,注重基础知识的巩固,侧重能力的培养。该题的关键是明确在酸性条件下,硝酸盐的氧化性,特别是在离子共存中经常出现,有利于培养学生的发散思维能力。
本题难度:简单
5、实验题 (12分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: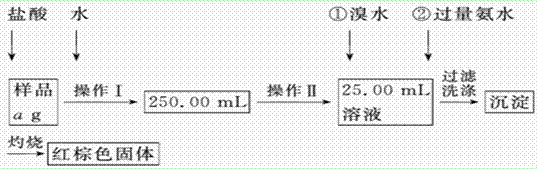
请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称),操作Ⅱ必须用到的仪器是________(填编号)。
A.50 mL烧杯
B.50 mL量筒
C.100 mL量筒
D.25 mL滴定管
(2)请写出加入溴水发 生的离子反应方程式
生的离子反应方程式 ________________________,加入氨水要过量的原因是___________________________。
________________________,加入氨水要过量的原因是___________________________。
(3)检验沉淀是否已经洗涤干净的操作是___________ _
_ _________________
_________________
___________ _______________________________________________。
_______________________________________________。
(4)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是______________ (列出原始计算式,不需化简);若称 量准确,最终测量的结果偏大,则造成误差的原因可能是___________________________
量准确,最终测量的结果偏大,则造成误差的原因可能是___________________________
________________________________。(写出一种原因即可)。
参考答案:
本题解析:略
本题难度:一般