时间:2017-08-26 00:44:27
1、选择题 下列物质中,既有离子键,又有共价键的是
[? ]
A.H2O
B.He
C.MgCl2
D.Na2O2
2、填空题 【物质结构与性质】(15分)
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_______种;
写出Cu+的核外电子排布式_________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有___________种,属于d区的元素有________种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是________。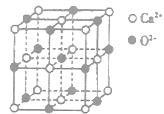
(4)由叠氮化钾(KN3)热分解可得纯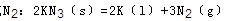 ,下列有关说法正确的是________(填选项字母)。
,下列有关说法正确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如右图所示,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为________,CNO-的中心原子的杂化方式为____________。
(6)在CrCl3溶液中,一定条件下存在组成为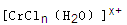 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: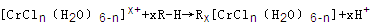
将含0.0015mol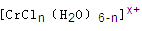 的溶液,与R-H完全交换后,中和生成的需浓度为
的溶液,与R-H完全交换后,中和生成的需浓度为
0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为____________。
3、选择题 下列化合物中既有离子键又有共价键的是( )
A.NaOH
B.H2S
C.CaCl2
D.H2O2
4、选择题 下列对分子性质的解释中,不正确的是
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.由于乳酸(  )中存在一个手性碳原子,导致该物质存在互为镜像的两个
)中存在一个手性碳原子,导致该物质存在互为镜像的两个
手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C.HF的稳定性很强,是因为其分子间能形成氢键
D.由下图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子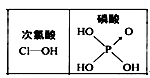
5、填空题 (8分)【化学-物质结构与性质】
碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序 为 。
为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb 4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为
4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为  ,每个Ba2+与 个O2-配位。
,每个Ba2+与 个O2-配位。