时间:2017-08-26 00:39:19
来源:91考试网 91ExaM.org1、选择题 已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42-
B.CrO42-、Br、Cl-
C.Br-、Cl-、CrO42-
D.Br、CrO42-、Cl-
参考答案:C
本题解析:设Cl-、Br-、CrO42-刚开始沉淀时,银离子的浓度分别为x mol、y mol、z mol,则根据Ksp可得:
0.01x=1.56×10-10
0.01y=7.7×10-13
0.01z2=9×10-11
可分别解出x≈1.56×10-8 y≈7.7×10-13 z≈3××10-4.5
可知y<x<z,开始沉淀时所需要的银离子浓度越小,则越先沉淀,因此答案为C
本题难度:一般
2、填空题 (16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
已知:(
参考答案:
本题解析:
本题难度:困难
3、选择题 已知如下物质的溶度积常数:FeS,Ksp=6.3×10-18;CuS,Ksp=1.3×10-36;ZnS,Ksp=1.6×10-24。下列说法正确的是? ( )
A.同温度下,CuS的溶解度大于ZnS的溶解度
B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol·L-1
C.因为H2SO4是强酸,所以Cu2++H2S=CuS↓+2H+不能发生
D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂
参考答案:D
本题解析:根据Ksp的大小可知,CuS的溶解度最小,A错。B选项中c(Cu2+)=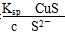 ,由于0.1 mol·L-1的H2S中,c(S2-)远远小于0.1 mol·L-1,故Cu2+浓度的最大值大于1.3×10-35mol·L-1,B错。C项中,由于CuS不溶于稀硫酸,故该反应可以发生,C错。D项中,根据FeS(s)
,由于0.1 mol·L-1的H2S中,c(S2-)远远小于0.1 mol·L-1,故Cu2+浓度的最大值大于1.3×10-35mol·L-1,B错。C项中,由于CuS不溶于稀硫酸,故该反应可以发生,C错。D项中,根据FeS(s) Fe2+(aq)+S2-(aq),由于Ksp(CuS)小于Ksp(FeS),故Cu2+会与S2-结合生成CuS,D正确。
Fe2+(aq)+S2-(aq),由于Ksp(CuS)小于Ksp(FeS),故Cu2+会与S2-结合生成CuS,D正确。
本题难度:一般
4、填空题 (10分)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,?控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见图。
(1)pH=3时溶液中铜元素的主要存在形式是:?(写化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为?(填字母)
A、<1? B、4左右? C、>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,?(能、不能)通过调节溶液pH的方法来除去,理由是?
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以 加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。?
加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。?
(5)已知一些难溶物的溶度积常数如下表。
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |

参考答案:(9分)
本题解析:略
本题难度:一般
5、选择题 工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2.由此可推知MnS( )
A.具有吸附性
B.溶解度小于CuS、PbS
C.溶解度与CuS、PbS相同
D.溶解度大于CuS、PbS
参考答案:解;工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2,原理利用的是沉淀转化的反应关系,沉淀转化的条件是向更难溶的方向进行,说明生成的CuS、PbS溶解性小于MnS;才能是先沉淀的转化,除去杂质;
故选D.
本题解析:
本题难度:一般