时间:2017-08-26 00:39:19
1、选择题 下列有关沉淀溶解平衡的说法中,正确的是(?)
A. Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大
C.在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
D.向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀
2、选择题 25℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为:Ksp(FeS)=6.3×10-18;Ksp(CuS)=1.3×10-36;Ksp(ZnS)=1.6×10-24.下列关于常温时的有关叙述正确的是( )
A.硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B.将足量的ZnSO4晶体加入到0.1mol/L的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-23mol/L
C.除去工业废水中含有的Cu2+,可采用固体FeS作为沉淀剂
D.向饱和的FeS溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小、但Ksp(FeS)变大
3、计算题 (12分)
Ⅰ.已知常温下,AgCl的Ksp=1.8×10-10,AgBr的Ksp=4.9×10-13。
(1)现向AgCl的悬浊液中:
①加入AgNO3固体,则c(Cl-)?(填“变大”、“变小”或“不变”,下同);
②若改加更多的AgCl固体,则c(Ag+)?;
③若改加更多的KBr固体,则c(Ag+)?,c(Cl-)?;
(2)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是?;
A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度, Ksp 一定增大
B.两种难溶盐电解质,其中Ksp小的溶解度也一定小
C.难溶盐电解质的Ksp与温度有关
D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
Ⅱ.最近有人制造了一种燃料电池使汽油氧化直接产生电流,其中一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以辛烷为汽油的代表物,则这个电池放电时必发生反应的化学方程式是?。
(2)这个电池负极的电极反应式为C8H18 + 25O2- -50e-==8CO2 + 9H2O,,正极的电极反应式为?。固体电解质里O2-的移动方向是?,向外电路释放电子的电极是?。
4、选择题 已知常温下Mg(OH)2的Ksp=1.8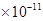 。若某氢氧化镁溶液的PH=9,则该溶液中c(Mg2+)最大为
。若某氢氧化镁溶液的PH=9,则该溶液中c(Mg2+)最大为
A.0.18mol/L
B.1.8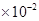 mol/L
mol/L
C.1.8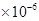 mol/L
mol/L
D.2.0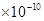
5、填空题 难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下溶解平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下: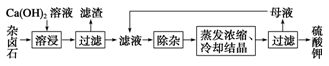
(1)滤渣主要成分有________和CaSO4以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。由图可得,随着温度升高,
① ,
② ,
③溶浸出的K+的平衡浓度增大。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32- CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K= 。
CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K= 。