时间:2017-08-26 00:29:24
1、实验题 ⑴有一学生在实验室测某溶液pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
①这种错误操作?(填“一定”/“一定不”/“不一定”)会导致实验结果有误差。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是?。
⑵、用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考右图,从表中选出正确序号 _____________
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 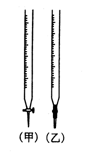 选用滴定管 选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| 实验 编号 | 待测氢氧化钠溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) | 消耗盐酸体积(mL) |
| ① | 25.00 | 0.02 | 26.40 | ? |
| ② | 25.00 | 0.04 | 25.81 | ? |
| ③ | 25.00 | 0.03 | 25.78 | ? |
| ④ | 25.00 | 0.20 | 25.96 | ? |
参考答案:⑴①不一定? ②盐酸?⑵? D ?⑶? ADE?⑷? 0.1158mol/L
本题解析:(1)①用用蒸馏水润湿后pH试纸测量溶液的pH时,相当于把原溶液稀释,所以不一定产生误差。例如原溶液显中性,则是不影响的。
②由于醋酸是弱酸,存在电离平衡,而稀释促进电离,所以若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的应该是盐酸。
(2)用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,则需要碱式滴定管,即选择乙;又因为一般不选择石蕊试液作指示剂,所以应该选择酚酞作指示剂,即答案选D。
(3)由于等质量的碳酸钠消耗的盐酸小于等质量的氢氧化钠消耗的盐酸,所以在滴定过程中消耗的碱液体积偏多,则测定结果偏高;滴定管的刻度自上而下是逐渐增大的,所以滴定终点读数时,俯视滴定管的刻度,则读数偏小,所以测定结果偏低;C中是必要影响的;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,则消耗氢氧化钠溶液的体积偏多,所以测定结果偏高;未用标准液润洗碱式滴定管,则相当于稀释氢氧化钠溶液,所以消耗氢氧化钠溶液的体积偏多,测定结果偏高,因此答案选ADE。
(4)根据表中数据可知,消耗的盐酸体积分别是25.98ml、25.77ml、25.75ml、25.76ml,所以消耗盐酸的平均值是(25.98ml+25.77ml+25.75ml+25.76ml)÷4=25.87ml,所以氢氧化钠溶液的浓度是25.87ml×0.112mol/L÷25.00ml=0.1158mol/L。
点评:在进行中和滴定误差分析时,需要依据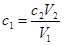 ,即在实验过程中,V1和C2是不变的,因此关键是分析操作是如何导致V2变化的即可。
,即在实验过程中,V1和C2是不变的,因此关键是分析操作是如何导致V2变化的即可。
本题难度:一般
2、选择题 某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L。x与y的关系图所示,下列说法正确的是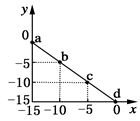
A.该温度高于25℃
B.图中a点溶液呈碱性
C.该温度下,0.01 mol·L-1的HCl溶液的pH=2
D.该温度下,0.01 mol·L-1的NaOH溶液的pH=12
参考答案:BC
本题解析:A、c(OH-)+c(H+)=10-15,而25°时c(OH-)+c(H+)=10-14,故该温度应低于25℃。
B、a点对应的c(H+)=10—15mol/L,c(OH-)=0mol/L,故为碱性。
C、0.01 mol·L-1的HCl溶液中c(H+)=10-2,根据pH=-㏒10(H+),得PH=2。
点评:此题考核了溶液PH和氢离子、氢氧根离子的关系,熟悉掌握PH的计算式,难度不大。
本题难度:一般
3、选择题 250C时,重水(D2O)的离子积为1.6×10-15也可用pH值一样的定义来规定其酸碱度:pD==-lgCD+,下列叙述正确的是(? )
①中性D2O的pD=7
②在1LD2O中,溶解0.01molDCl,其pD值为1
③1L0.1mol/L的NaOD的重水溶液,pD=12
④在100mL0 .25rnoL/LDCl的重水溶液中,加入50mL0. 2mo1./L NaOD的重水溶液,反应后溶液的pD=1
⑤温度升高,CD+×COD-的值会升高
A.②③
B.③④
C.①②
D.④⑤
参考答案:D
本题解析:略
本题难度:一般
4、选择题 下列热化学方程式中 ΔH的数值能表示可燃烧热的是
A.H2(g) + Cl2(g) =" 2HCl(g)" ΔH =-184.6kJ/mol
B.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g)ΔH =-802.3kJ/mol
C.2H2(g) + O2(g) = 2H2O(l)ΔH =-571.6kJ/mol
D.CO(g) + 1/2O2(g) = CO2(g)ΔH =-283kJ/mol
参考答案:D
本题解析:略
本题难度:一般
5、填空题 (8分)在中和滴定中,稀盐酸是常用的滴定剂,而盐酸标准溶液的浓度又常常是以氢氧化钠作基准物质标定的,某学生为此进行如下操作:?
a.用蒸馏水分别洗净酸式滴定管和锥形瓶,并排出滴定管尖嘴部位的气泡;?
b.用待标定盐酸润洗滴定管内壁3次(每次用量2~3 mL);?
c.向滴定管内注入待标定盐酸,记录管内液面所在刻度V1 mL;?
d.将准确称取的W g干燥的NaOH放入锥形瓶中,加25 mL蒸馏水,振荡使之溶解;?
e.滴入1滴酚酞指示剂;?
f.在锥形瓶下铺一张白纸,向瓶内滴加待标定的盐酸,边滴边摇动锥形瓶,直到溶液的红色刚好褪去,并不再变红,即为滴定终点;?
g.记录滴定管内液面所在刻度V2 mL。?
(1)若该生操作无误,则所标定盐酸的物质的量浓度为?。?
(2)在进行滴定操作时,操作者的眼睛应注视?。?
(3)若该生在溶解固体氢氧化钠时,用了28 mL蒸馏水,则所标定盐酸的浓度值将?
?(填“偏高”、“偏低”、“无影响”)。?
(4)若该生记录滴定管内液面所在刻度时,滴定前是仰视读数,达滴定终点是平视读数,则所标定盐酸的浓度值将?(填“偏高”、“降低”、“无影响”)。
参考答案:(1)W/40(V2-V1) mol·L-1?(2)锥形瓶中溶液颜色变化?(3)无影响?
(4)偏高?
本题解析:1、根据盐酸与氢氧化钠反应的化学方程式可知,反应消耗盐酸与氢氧化钠物质的量之比为1:1,即消耗的盐酸物质的量等于消耗氢氧化钠物质的量(W/40),W/40=(V2
-V1 )C? C= W/40(V2-V1) mol·L-1?
2进行滴定操作时,操作者的眼睛应注视锥形瓶中溶液颜色变化.
3若该生在溶解固体氢氧化钠时,用了28 mL蒸馏水,则所标定盐酸的浓度值将无影响,因为定容的时候也要加水。
4、若该生记录滴定管内液面所在刻度时,滴定前是仰视读数,使得读数偏大,达滴定终点是平视读数,则所测出的氢氧化钠体积偏小,则所标定盐酸的浓度值将偏高
点评:本题属于中等题,难度不大,主要考察了溶液的配制及其操作,掌握读数时仰视和俯视对读数的影响使解题的关键。
本题难度:简单