时间:2017-08-26 00:24:37
1、填空题 如图3-1所示,在密闭容器里盛有饱和H2S溶液和H2S气体。
(1)饱和H2S溶液中存在的分子有____________,离子有______________________________。
(2)若将容器顶盖由a压到b位置,则H2S溶液中,各离子浓度的变化情况是________离子浓度增大,而________离子浓度减小。
(3)若从c处不断通入过量的SO2气体,溶液中H+浓度将(? )
A.不断增大
B.先减小,后增大到某值
C.不变
D.先增大,后减小到某值
(4)若由c处不断通入N2,则溶液中H+浓度将________。(填“变大”“变小”或“不变”)
图3-1
参考答案:(1)H2S、H2O? H+、HS-、S2-、OH-
(2)H+、HS-、S2-? OH-?(3)B?(4)变小
本题解析:本题若不清楚氢硫酸的电离平衡,或忽略溶液中的H2O将会导致(1)中出错。若不用勒夏特列原理分析溶解平衡、电离平衡,将导致(2)题的分析中思维混乱。
解答本题的关键是要认识到密闭容器中存在如下平衡体系: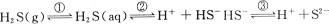
其中平衡①属气体的溶解平衡,②和③属电离平衡。
(1)由上述平衡体系可知,溶液中存在的分子有H2S、H2O;离子有H+、HS-、S2-、OH-。
(2)当顶盖由a压向b时,气体压强增大①向右移动,c〔H2S(aq)〕增大,致使平衡②③均右移。所以浓度增大的离子有H+、HS-、S2-;浓度减小的离子有OH-。
(3)通入SO2气体,SO2与H2S反应生成S和H2O,使H2S(g)浓度减小,平衡①左移,c〔H2S(aq)〕减小,故c(H+)、c(HS-)、c(S2-)均减小,当SO2过量时,SO2和H2O反应生成比氢硫酸酸性更强的H2SO3,故c(H+)再变大,若充入足量的SO2,最后溶液中c(H+)比原来更大。故选B。
(4)若由c处不断通入N2,则顶盖将向上移动,使H2S(g)的浓度减小,平衡①左移,导致c(H+)、c(HS-)、c(S2-)均减小。
本题难度:简单
2、选择题 c(H+)相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是
[? ]
①反应所需要的时间B>A;
②开始反应时的速率A>B;
③参加反应的锌的物质的量A=B;
④反应过程的 平均速率B>A;
⑤盐酸里有锌剩余;
⑥醋酸里有锌剩余。
A.③④⑥
B.②③⑥
C.③④⑤
D.①②⑤
参考答案:C
本题解析:
本题难度:一般
3、选择题 把0.05 mol NaOH固体,分别加入下列100 mL溶液中,溶液的导电能力变化不大的是( )①自来水②0.5 mol·L-1盐酸 ③0.5 mol·L-1醋酸?④0.5 mol·L-1 NH4Cl溶液
A.①②
B.②④
C.③④
D.②③
参考答案:B
本题解析:①变化很大,自来水导电能力很弱,当加入氢氧化钠固体后,溶液的导电能力突然增强;②变化不大,当加入0.05 mol NaOH固体于100 mL 0.5 mol·L-1盐酸时,两者反应生成氯化钠和水,氯化钠为强电解质,结果使得溶液的导电能力变化不大;③变化比较大,0因醋酸为弱酸,当加入氢氧化钠后,反应生成醋酸钠成为强电解质,使得溶液的导电能力增强;④变化不大,当加入氢氧化钠固体后,会反应生成一水合氨和氯化钠,氯化钠为强电解质,而一水合氨为弱电解质,使得溶液的导电能力变化不大;
本题难度:简单
4、填空题 (14分)(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示: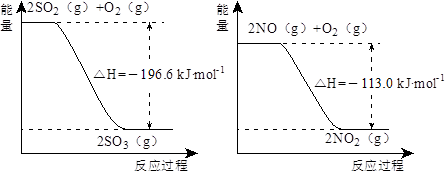
则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g) N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |

参考答案:(1) NO2(g)+SO2(g) SO3(g)+NO(g)? ΔH=-41.8KJ/mol; (2)40%;
SO3(g)+NO(g)? ΔH=-41.8KJ/mol; (2)40%;
(3)①增大,减小;② =;③4.35×10-5;④2H2A+CO32-=2HA-+CO2↑+H2O
本题解析:(1)根据图一可知热化学方程式为①2SO2(g) +O2(g)  2SO3(g)ΔH="-196.6KJ/mol;" ②2NO(g)+ O2(g)
2SO3(g)ΔH="-196.6KJ/mol;" ②2NO(g)+ O2(g)  2NO2(g) ΔH="-113.0KJ/mol;" ①-②整理可得NO2(g)+SO2(g)
2NO2(g) ΔH="-113.0KJ/mol;" ①-②整理可得NO2(g)+SO2(g)  SO3(g)+NO(g)? ΔH =-41.8KJ/mol;(2)由于反应是在体积固定的容器中进行,所以反应前后的压强比等于气体的物质的量的比。2NH3(g)
SO3(g)+NO(g)? ΔH =-41.8KJ/mol;(2)由于反应是在体积固定的容器中进行,所以反应前后的压强比等于气体的物质的量的比。2NH3(g) N2(g)+3H2(g)假设有2xmol的氨气反应,则产生N2=xmol;产生H2=3xmol。还有未反应的氨气的物质的量为(1-2x)mol.n(前):n(后)=1:((1-2x)+x+3x)=1:(1+2x)=5:7.解得x=0.2.所以氨气的转化率为(2×0.2)÷1×100%=40%;(3)?①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,发生反应:HA-+OH-=H2O+A2-,所以c(A2-)/c(HA-)的值增大;当不断加入NaOH溶液时,c(H+)减小,c(OH-) 增大,所以c(H+)/c(OH-) 的值减小。②根据物料守恒可得c(Na+)= c(HA-)+ c(H2A)+ c(A2-);根据电荷守恒可得:c(Na+)+ c(H+)+ c(NH4+)= c(OH-)+ 2c(A2-)+ c(HA-)。又因为溶液显中性,所以c(H+)= c(OH-)。将三个式子整理可得c(H2A)+c(NH4+)=c(A2-)。③HA-
N2(g)+3H2(g)假设有2xmol的氨气反应,则产生N2=xmol;产生H2=3xmol。还有未反应的氨气的物质的量为(1-2x)mol.n(前):n(后)=1:((1-2x)+x+3x)=1:(1+2x)=5:7.解得x=0.2.所以氨气的转化率为(2×0.2)÷1×100%=40%;(3)?①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,发生反应:HA-+OH-=H2O+A2-,所以c(A2-)/c(HA-)的值增大;当不断加入NaOH溶液时,c(H+)减小,c(OH-) 增大,所以c(H+)/c(OH-) 的值减小。②根据物料守恒可得c(Na+)= c(HA-)+ c(H2A)+ c(A2-);根据电荷守恒可得:c(Na+)+ c(H+)+ c(NH4+)= c(OH-)+ 2c(A2-)+ c(HA-)。又因为溶液显中性,所以c(H+)= c(OH-)。将三个式子整理可得c(H2A)+c(NH4+)=c(A2-)。③HA- H++A2-。由图像可知。当达到电离平衡时c(HA-)=c(A2-).
H++A2-。由图像可知。当达到电离平衡时c(HA-)=c(A2-). 。④由于H2A过量,结合两种酸的电离平衡常数可知过量的H2A加入到Na2CO3溶液中反应的离子方程式为:2H2A+CO32-=2HA-+CO2↑+H2O。
。④由于H2A过量,结合两种酸的电离平衡常数可知过量的H2A加入到Na2CO3溶液中反应的离子方程式为:2H2A+CO32-=2HA-+CO2↑+H2O。
本题难度:一般
5、选择题 在100ml下列溶液中,分别加入0.05molNaOH固体,溶液的导电性变化不大的是
A.蒸馏水
B.0.5mol/L的CH3COOH
C.0.5mol/L的HCl
D.0.5mol/L的氨水
参考答案:C
本题解析:溶液的导电性强弱主要和溶液中离子浓度大小以及离子的电荷数有关系。离子浓度越大,电荷数越多,溶液导电性越强。A中离子浓度增加,导电性增强;B中有强电解质醋酸钠生成,导电性增强;C中生成氯化钠,导电性变化不大;D中离子浓度增大,导电性增强,答案选C。
点评:该题的关键是理解溶液的导电性和离子的种类、个数多少无关系。主要是看溶液中离子浓度的大小和离子电荷数,据此可以判断。同时还需要熟练记住常见的强电解质。
本题难度:一般