时间:2017-08-26 00:19:50
1、填空题
(1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①________和__________两种粒子的物质的量之和等于0.1mol。
②________和__________两种粒子的物质的量之和比OH-多0.05mol。
(2) 已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是___________,上述离子浓度大小顺序关系中正确的是(选填序号)___________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)___________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系
c(NH4+)___________c(Cl-)。
参考答案:(1)①NH3·H2O和NH4+
②NH4+和H+
(2)①氯化铵;A?
②NH4Cl和HCl?
③<;=
本题解析:
本题难度:一般
2、选择题 室温下,在25mL?0.1mol.L-1NaOH溶液中逐滴加入0.2mol?L-1?CH3COOH?溶液,pH?与滴加?CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有c(Na+)═c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1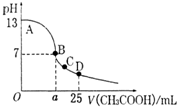
参考答案:A、在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:
c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B、在B点溶液显中性,则结果是c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有
c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B正确;
C、在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),故C错误;
D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:
c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,故D正确;
故选C.
本题解析:
本题难度:一般
3、选择题 用0.1mol·L-1的盐酸滴定0.1mol·L-1的氨水,在滴定过程中不可能出现的结果是
[? ]
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列物质的水溶液能导电,但属于非电解质的是
[? ]
参考答案:D
本题解析:
本题难度:简单
5、填空题 (8分)有以下几种物质:①食盐晶体②乙醇③水银④蔗糖⑤冰醋酸(纯醋酸晶体)⑥KNO3溶液⑦熔融的氢氧化钠?⑧液态氯化氢?填空回答(填序号):
(1)物质中构成的微粒只能在固定位置上振动的是? ;
(2)以上物质可以导电的是?;
(3)以上物质中属于电解质的是?;
(4)以上物质中属于非电解质的是?。
参考答案:(8分)(1)①④⑤(2)③⑥⑦(3)①⑤⑦⑧(4)②④
本题解析:(10物质中构成的微粒只能在固定位置上振动,说明应该是晶体,所以答案选①④⑤。(2)金属或电解质溶液或熔融的电解质都是可以导电的,所以答案是③⑥⑦。
(3)溶于水或熔融状态下,能够电离出阴阳离子的化合物是电解质,所以答案选①⑤⑦⑧。
(4)溶于水和熔融状态下,都不能电离出阴阳离子的化合物是非电解质,所以答案选②④。
本题难度:一般