时间:2017-08-22 16:58:45
1、选择题 关于 的下列说法中不正确的是( )
的下列说法中不正确的是( )
A.是有机酸
B.是芳香酸
C.是一元羧酸
D.不能发生酯化反应
参考答案:D
本题解析: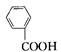 分子中有一个
分子中有一个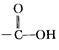
本题难度:一般
2、简答题 某学生用如图装置来做浓硫酸和木炭反应的实验:C+2H2SO4(浓)

参考答案:(1)反应C+2H2SO4(浓)△.CO2↑+2SO2↑+2H2O中生成二氧化硫气体,所以装置B中品红溶液褪色,证明生成的气体中含有SO2,
故答案为:品红溶液褪色;SO2;
(2)装置C中酸性KMnO4溶液用于除去SO2,利用了二氧化硫的还原性,除去二氧化硫的目的是防止SO2干扰CO2的检验,所以甲正确,
故答案为:还原性;甲;
(3)装置D中品红溶液不褪色,说明装置C已经将混合气体的二氧化硫除尽,
故答案为:已除尽;
(4)装置E中为澄清石灰水,二氧化碳气体能够使澄清石灰水变浑浊,所以装置E中澄清石灰水变浑浊,由于二氧化硫已经除尽,说明混合气体中一定含有二氧化碳,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,
故答案为:溶液变浑浊;CO2+Ca(OH)2=CaCO3↓+H2O;
(5)6gC的物质的量为:6g12g/mol=0.5mol,根据碳原子质量守恒可得,生成二氧化碳的物质的量为0.5mol,标准状况下0.5mol二氧化碳的体积为:22.4L/mol×0.5mol=11.2L,
故答案为:11.2L.
本题解析:
本题难度:简单
3、简答题 工业接触法制硫酸的流程如图所示:
(1)写出沸腾炉中发生反应的化学方程式:______.
(2)从沸腾炉出来的气体经净化干燥处理后进入接触室,其气体体积组成:SO2 7%,O2 11%,N2 82%.从接触室出来的气体中SO3 的体积分数为7%,则SO2的转化率为______.
(3)接触室采用常压而不采用高压的原因是______.
(4)在吸收塔中用98.3%的浓硫酸吸收SO3 ,而不是用水吸收SO3 的原因是______.
每100g?SO3 与H2O完全反应放出热量162.9kJ,该反应的热化学方程式为______.
(5)某硫酸厂每天用含FeS2 60%的黄铁矿500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2 的转化率为90%.每天能生产98%的硫酸______t.
参考答案:(1)FeS2与O2在高温条件下生成Fe2O3和SO2,故答案为:4FeS2+11O2?高温?.?2Fe2O3+8SO2;
(2)设总体积为100
2SO2+O2=2SO3
初始 7 11 0
转化 x 12x x
平衡 7-x 11-12x x
x7-x+11-12x+x+82=7%
x=1400207
转化率=x7×100%=96.6%,故答案为:96.6%;
(3)常压时SO2的转化率已经很高,采用高压对SO2的转化率提高不多,却会大大增加设备成本,故答案为:常压时SO2的转化率已经很高,采用高压对SO2的转化率提高不多,却会大大增加设备成本;
(4)△H=-162.9KJ×80g/mol100g=-130.3KJ/mol,故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130.3KJ/mol;
(5)沸腾炉中损失5%的硫,SO2转化率为90%这些都可转化为S元素的损失,进而转化为FeS2的损失.所以设生产98%的硫酸x吨.则由关系式:
?FeS2------------2H2SO4?
?120?2×98
?500t×60%×(1-5%)×90%?x×98%?
解得?x=427.5t,
故答案为:427.5.
本题解析:
本题难度:一般
4、选择题 利尿酸在奥运会上被禁用,其结构简式如下图所示,下列叙述正确的是(? )
A.利尿酸分子内处于同一平面的原子不超过1O个
B.利尿酸能与FeCI3溶液发生显色反应
C.1mol 利尿酸最多能与4mol H2发生加成反应
D.1mol 利尿酸与足量NaOH溶液发生反应,最多能消耗5mol NaOH
参考答案:D
本题解析:A 错误,苯是一个平面结构,所以苯环以及和苯环直接相连的原子都在一个平面上,应该至少有12个原子共平面。
B 错误,利尿酸没有酚羟基,不能与FeCI3溶液发生显色反应
C 错误,1mol 利尿酸最多能与5mol H2发生加成反应
D 正确,苯环上的1mol氯原子能消耗2mol NaOH,苯环上有2mol氯原子,消耗4mol NaOH,羧基消耗1mol NaOH,共消耗5mol NaOH。
本题难度:一般
5、简答题 用如下图所示各装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物.
(1)浓硫酸和木炭加热的化学方程式:______.
(2)这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的序号):______→______→______→______.
(3)装置②中要检验产物中有水蒸汽,则放入的药品是:______;装置③中要检验产物中有二氧化碳气体,则放入的药品是:______;实验时可观察到装置①中A瓶的溶液退色,C瓶的溶液不退色.A瓶溶液的作用是______,B瓶溶液的作用是______,C瓶溶液的作用是______.
参考答案:(1)浓硫酸具有氧化性,与木炭共热生成CO2、SO2和H2O,反应的化学方程式为:C+2H2SO4?△?.?CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4?△?.?CO2↑+2SO2↑+2H2O;
(2)反应生成CO2、SO2和H2O,应先检验水蒸气的存在,因为在验证二氧化碳、二氧化硫的存在时都需通过溶液,可带出水蒸气;二氧化碳、二氧化硫都能使澄清的石灰水变浑浊,所以不能先通过澄清的石灰水来检验二氧化碳的存在,所以先检验二氧化硫的存在并除去二氧化硫后才检验二氧化碳的存在.检验过程应为检验水蒸气→检验并除尽二氧化硫→检验二氧化碳,故答案为:④;②;①;③;
(3)水蒸气用无水硫酸铜为白色固体遇水变蓝检验;装置②中要检验产物中有水蒸汽,则放入的药品是:无水硫酸铜;装置③中要检验产物中有二氧化碳气体,二氧化碳的检验方法为通过澄清的石灰水,使澄清的石灰水变浑浊.则放入的药品是:澄清石灰水;实验时可观察到装置①中A瓶的溶液退色,C瓶的溶液不退色,SO2能使红色的品红溶液褪色,CO2不能使红色的品红溶液褪色,因此装置A中盛有红色的品红溶液来检验二氧化硫;二氧化硫影响二氧化碳的检验,因此检验二氧化碳前先除尽二氧化硫,装置B中盛有的酸性高锰酸钾溶液除去二氧化硫,而不除去二氧化碳,装置C中的红色的品红溶液是用来证明SO2气体已完全除尽的,
故答案为:无水硫酸铜粉末;澄清石灰水;检验二氧化硫的存在;除去气体中的SO2;证明SO2气体已完全除尽.
本题解析:
本题难度:一般