时间:2017-08-22 16:41:30
1、选择题 向15.0mL?1.0mol?L-1的(NH4)Al(SO4)2溶液中逐滴加入1.0mol?L-1的NaOH溶液,并不断搅拌.当生成0.78g沉淀时,所用NaOH溶液的体积可能为
A.30?mL
B.45?mL
C.50?mL
D.65?mL
参考答案:AD
本题解析:分析:向(NH4)Al(SO4)2溶液中逐滴加入NaOH溶液,所发生的反应有:①Al3++3OH-=Al(OH)3↓;②NH4++OH-=NH3↑+H2O;③Al(OH)3+OH-=AlO2-+2H2O,根据发生反应的情况来计算回答.
解答:关于消耗NaOH的反应有三个,反应顺序如下:①Al3++3OH-=Al(OH)3↓;②NH4++OH-=NH3↑+H2O;③Al(OH)3+OH-=(AlO2)-+2H2O,生成的沉淀肯定是Al(OH)3 ,0.78g是0.01mol,有Al3+共0.015mol;当NaOH不足时只发生反应①,则消耗NaOH 0.03mol,体积是30ml,故A正确;当NaOH过量时①②③反应同时发生,则0.015molAl3+全部参加反应,其中0.005mol最终转化成AlO2-,全部的0.015molNH4+变成NH3,所以共消耗NaOH:0.015×3+0.005*×1+0.015=0.065mol,体积是65ml,故D正确.故选AD.
点评:本题考查学生含铝化合物和氢氧化钠之间的反应情况,注意发生反应的先后情况是解题的关键,难度不大.
本题难度:一般
2、选择题 已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是
A.0.01mol?L-1的蔗糖溶液
B.0.02mol?L-1的NaCl溶液
C.0.01mol?L-1的CaCl2溶液
D.0.02mol?L-1的酒精溶液
参考答案:B
本题解析:分析:根据溶液中非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,则假设溶液为1L时计算选项中溶质的物质的量来比较即可解答.
解答:A、因1L蔗糖溶液中蔗糖的物质的量为1L×0.01mol/L=0.01mol;
B、因1LNaCl溶液中溶质的离子的总物质的量为1L×0.02mol/L×2=0.04mol;
C、因1LCaCl2溶液溶质的离子的总物质的量为1L×0.01mol/L×3=0.03mol;
D、因酒精是挥发性溶质,且1L溶液中分子的物质的量为1L×0.02mol/L=0.02mol,所以D不符合题意;
显然B中含0.04?mol离子,离子数最多,
故选:B.
点评:本题考察了学生利用信息的能力,利用非挥发性溶质的分子或离子数来判断溶液的沸点高低,学生熟悉物质的量浓度的有关计算是解答的关键,并会判断挥发性物质来解答即可.
本题难度:困难
3、选择题 下列说法错误的是
A.含有磷元素生活污水排入江河易引起水体富营养化,造成藻类过度繁殖影响水质
B.“食用色素”、“亚硝酸盐”在某些食品添加剂中允许有,符合限量不会引起中毒
C.航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,是一种有机材料
D.实行“汽车下乡”政策、大力推广使用家用小轿车不利于节能减排
参考答案:C
本题解析:分析:A、磷是植物的营养元素,能促进藻类生长;
B、并非所有的添加剂都是有害的,适量添加并不会引起中毒;
C、依据航天材料的组分确定为复合材料分析;
D、家用小轿车增多,汽车尾气增多会造成大气污染.
解答:A、含有磷元素生活污水排入江河易引起水体富营养化,造成 藻类过度繁殖影响水质,造成水体污染,故A正确;
B、“食用色素”、“亚硝酸盐”在某些食品添加剂中允许有,并非所有的添加剂都是有害的,符合限量不会引起中毒,故B正确;
C、各成分都是由非金属元素组成的无机物,碳纤维复合材料是主要由碳单质做成,是一种复合材料,所以是一种新型复合材料,故C错误;
D、实行“汽车下乡”政策、大力推广使用家用小轿车,排出大量汽车尾气,不利于节能减排,故D正确;
故选C.
点评:本题考查了常见生活环境污染和防治措施,主要考查水体富营养化,食品添加剂的使用,新型无机非金属材料,汽车尾气等,题目难度中等.
本题难度:简单
4、选择题 德国人弗里茨·哈伯(Fritz Haber)因发明合成氨的方法获得1918年诺贝尔化学奖,他的发明不仅大大提高了农作物的产量,同时也提高了硝酸、炸药的产量.下列说法中正确的是
A.N2和H2在点燃或光照的条件下可以合成氨
B.氨和硝酸都是电解质
C.氨遇到湿润的红色石蕊试纸会变蓝
D.由氨制取硝酸的过程中,氮元素被还原
参考答案:C
本题解析:N2和H2要在催化剂、加热、加压的条件下才能生成氨.氨是非电解质.由氨制取硝酸的过程中,氮元素的化合价升高,被氧化.
本题难度:困难
5、选择题 一定条件下,16gA和22gB恰好反应生成0.25molC和4.5gD,从上述事实可推知C相对分子质量为
A.67
B.134
C.134g/mol
D.268g/mol
参考答案:B
本题解析:分析:根据质量守恒,得出C的质量,再根据质量、摩尔质量、物质的量之间的关系,求出C的摩尔质量,根据摩尔质量在数值上等于相对分子质量.
解答:16gA恰好能跟22gB完全反应,生成0.25molC和和4.5gD,根据质量守恒,得出C的质量33.5g,C的摩尔质量=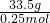 =134g/mol,C相对分子质量为134,
=134g/mol,C相对分子质量为134,
故选B.
点评:本题难度不大,考查学生运用质量守恒定律进行计算的能力,需要注意的是摩尔质量在数值上等于相对分子质量.
本题难度:简单