时间:2017-08-22 16:40:04
1、选择题 下列各组实验中溶液最先变浑浊的是( )
A.0.1mol/L Na2S2O3和H2SO4各5mL,加水5mL,反应温度10℃
B.0.1mol/L Na2S2O3和H2SO4各5mL,加水10mL,反应温度10℃
C.0.1mol/L Na2S2O3和H2SO4各5mL,加水5mL,反应温度30℃
D.0.1mol/L Na2S2O3和H2SO4各5mL,加水10mL,反应温度30℃
参考答案:C
本题解析:试题分析:溶液最先变浑浊的是反应速率最快的,C和D 的温度最高,而C的浓度最大,故选C。
考点:化学反应速率
点评:此题是化学反应速率的变形题目,只要能抓住本质,另外也需注意的是,在影响化学反应速率的因素中,催化剂影响最大,温度次之,压强和浓度更次之。
本题难度:一般
2、填空题 某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)该研究小组是否成功制得 +1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
(2)甲与水反应可得H2,其化学方程式是 。反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2· xCa(OH)2· 12H2O。为确定x的值,请设计实验方案 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
参考答案:(1)否 (1分)CaHCl (2分)
(2)2CaHCl + 2H2O = CaCl2 + Ca(OH)2 + 2H2↑(2分)
取样,加稀HNO3溶解后分成二等份,其中一份加入Na2CO3溶液,得到CaCO3沉淀,称重后求得n(Ca2+);另一份加入AgNO3溶液,得到AgCl沉淀,称重后求得n(Cl-), 用下式即可求得x值: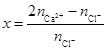 (3分,其它合理答案也给分)
(3分,其它合理答案也给分)
(3)2Cl- + MnO2 + 4H+= Mn2+ + Cl2↑+ 2H2O (2分)
保持FeCl2溶液呈酸性,并加入铁粉防止氧化 (2分)
(4)Ca + CaCl2 = 2CaCl
本题解析:(1)化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%,加起来比100%小,表明该物质中还含有氢元素,其质量分数为:100%-52.36%-46.33%=1.31%。因此,可以来确定甲这种物质的化学式:
N(Ca)
本题难度:一般
3、选择题 常温下,在溶液中可以发生反应:X + 2Y3+ ="=" X2+ + 2Y2+,则下列解释正确的是
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物
⑤Y2+具有还原性 ⑥Y3+ 的氧化性比X2+强
A.②⑤
B.②④⑥
C.①③④
D.①③⑤⑥
参考答案:D
本题解析:反应中X化合价升高生成X2+,X是还原剂,被氧化,具有还原性,Y3+化合价降低生成Y2+,Y3+是氧化剂,被还原,具有氧化性,由氧化剂的氧化性强于氧化产物的氧化性,可知Y3+ 的氧化性比X2+强,答案选D。
考点:氧化还原反应中六个概念
本题难度:一般
4、选择题 下列反应中,熵减小的是
A.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)
B.2N2O5(g)=4NO2(g)+O2(g)
C.MgCO3(s)=MgO(s)+CO2(g)
D.2CO(g)=2C(s)+O2(g)
参考答案:D
本题解析:考查熵的概念。熵一般是指体系的混乱度,对于同一种物质在固态时熵值最小,液态时其次,气态时最大。选项D中反应前是2mol气体,反应后只生成1mol气体,熵值减小。
本题难度:困难
5、选择题 已知溶液中可发生反应:2FeBr2+?Br2=?2FeBr3,现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl?和Br?的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
A.2mol·L-1
B.1mol·L-1
C.0.4mol·L-1
D.0.2mol·L-1
参考答案:A
本题解析:根据反应式可知,亚铁离子的还原性强于溴离子的,所以氯气首先氧化的是亚铁离子。设溴化亚铁的物质的量是x,氯气的物质的量是0.15mol,则根据电子的得失守恒可知,x+(2x-0.15×2)×1=0.15×2,解得x=0.2mol,所以溴化亚铁的浓度是0.2mol÷0.1L=2.0mol/L,答案选A。
本题难度:困难