时间:2017-08-22 16:36:22
1、选择题 用0.1000mol?L-1 NaOH溶液滴定20.00mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示.下列说法正确的是( )
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.0100mol?L-1?
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00 mL(忽略反应前后体积变化),该混合液的pH=1+lg3
参考答案:A.a点时加入NaOH较少,溶液中c(H+)较大,c(H+)越大,水的电离程度越小,则有水电离出的氢离子浓度:a<b,故A错误;
B.加入NaOH溶液20.00mL时,酸碱恰好中和,由c(酸)×V(酸)=c(碱)×V(碱)可知,盐酸的物质的量浓度为0.100 mol?L-1,故B错误;
C.指示剂为酚酞,溶液变色范围为8.2~10,溶液呈碱性,NaOH过量,并不是恰好完全反应,故C错误;
D.当滴加NaOH溶液10.00 mL时,酸过量,c(H+)=0.02L×0.1mol/L-0.01L×0.1mol/L0.03L=13×10-1mol/L,则pH=1+lg3,故D正确.
故选D.
本题解析:
本题难度:简单
2、选择题 已知100℃时,0.01mol?L-1NaHSO4溶液中水电离的c(H+)=10-10mol?L-1,该温度下将pH=8的Ba(OH)2溶液V1L与pH=5V2LNaHSO4混合,所得溶液pH=7,则V1:V2=( )
A.2:9
B.1:9
C.1:1
D.1:2
参考答案:硫酸氢钠溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,0.01mol?L-1NaHSO4溶液中C(H+)=0.01mol/L,水电离的c(H+)=c(OH-)=10-10mol?L-1,所以Kw=10-12;
该温度下,氢氧化钡溶液中c(OH-)=10-1210-8mol/L=10-4 mol/L,混合溶液呈碱性,
溶液中c(OH-)=10-1210-7mol/L=10-5 mol/L,
10-4×V1-10-5V2V1+V2=10-5,
所以V1:V2=2:9,故选A.
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是
[? ]
A.某氨水溶液的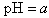 ,将此溶液稀释10倍后,溶液的
,将此溶液稀释10倍后,溶液的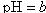 ,则b + 1= a
,则b + 1= a
B.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的pH = 7
至溶液恰好无色,则此时溶液的pH = 7
C.![]() 醋酸的
醋酸的![]() ,
,![]() 盐酸的pH小于7且接近7
盐酸的pH小于7且接近7
D.若1mL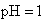 的盐酸与100mL
的盐酸与100mL![]() 溶液混合后,溶液
溶液混合后,溶液![]() 的则
的则![]() 溶液的
溶液的![]()
参考答案:D
本题解析:
本题难度:一般
4、选择题 室温时,某醋酸溶液的pH=3,其中的c(OH-)是( )
A.1×10-3mol/L
B.1×10-7mol/L
C.1×10-11mol/L
D.无法确定
参考答案:室温时,某醋酸溶液的pH=3,pH=-lgc(H+),所以c(H+)=1×10-3mol/L,室温时,Kw=c(OH-)×c(H+)=1×10-14,根据Kw=c(OH-)×c(H+),c(OH-)=10-1410-3mol/L=1×10-11mol/L,
故选:C.
本题解析:
本题难度:一般
5、选择题 某水溶液的pH是3,其中的c(OH-)是( )
A.0.1mol/L
B.1×10-3?mol/L
C.1×10-7?mol/L
D.1×10-11?mol/L
参考答案:D
本题解析:
本题难度:一般