时间:2017-08-22 16:27:33
1、选择题 常温下,0.1mol/LCH3COONa溶液中离子浓度最大的是( )
A.OH-
B.H+
C.Na+
D.CH3COO-
2、选择题 常温下,下列溶液中各离子浓度关系正确的是( ? )
A.等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3?H2O)
B.浓度为0.1?mol?L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
C.pH=12的氨水与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
3、选择题 常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性。则下列各项正确的是
[? ]
A、混合前:c(CH3COOH)>c(NaOH)
B、混合前:PH(CH3COOH)+PH(NaOH)=14
C、混合后:c(Na+)==c(CH3COO-)
D、混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
4、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A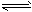 H++HA-,HA-
H++HA-,HA-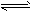 H++A2-,
H++A2-,
回答下列问题:
(1)Na2A溶液呈________(填“酸性”、“中性”或“碱性”),理由是:_______________________
(用离子方程式说明) NaHA溶液呈________(填“酸性”、“中性”或“碱性”),理由是:________________________。
(2)已知0.1mol/LNaHA溶液的pH=2,则0.1mol/L的H2A溶液中氢离子的物质的量浓度________0.11mol/L(填“<”、“>”或“==”)理由是:______________________________。
(3)0.1mol/LNaHA溶液中各种离子浓度由大到小的顺序是:________________________
5、选择题 常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
[? ]
A.某溶液中由水电离出的c(OH-)=1×10-a mol/L,当a>7时,该溶液的pH一定为14-a
B.将0.1 mol/L的某一元酸HA溶液和0.1 mol·L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(Na+)
C.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.常温下,NaHSO3溶液的pH<7,溶液中c(SO42-)<c(H2SO3)