时间:2017-08-22 16:05:52
1、选择题 常温下,稀释0.1mol?L-1Na2CO3溶液,图中的纵坐标可以表示( )
A.CO32-水解的平衡常数
B.溶液的pH
C.溶液中HCO3-离子数
D.溶液中c(CO32-)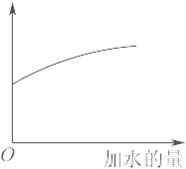
参考答案:A、水解的平衡常数只与温度有关,加水稀释平衡常数不变,故A错误;
B、加水稀释,溶液的体积增大,溶液中氢氧根离子浓度减小,所以稀释过程中溶液pH应逐渐减小,故B错误;
C、D、稀释过程中水解平衡CO32-+H2O?HCO3-+OH-向右移动,所以HCO3-数目增大,CO32-数目减少,c(CO2-3)减小,故C正确、D错误;
故选C.
本题解析:
本题难度:简单
2、选择题 短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+
B.X+、Y3+
C.Y3+、Z2-
D.X+、Z2-
参考答案:根据?短周期元素W、X、Y、Z的原子序数依次增大及各选项可以推出,W为O2-、X为Na+、Y为Al3+、Z为S2-,Al3+和S2-均能发生水解,水解打破了水的电离平衡;O2-不能在水溶液存在,而Na+不水解,故正确的是C;
故选C.
本题解析:
本题难度:一般
3、选择题 室温下,某浓度的醋酸溶液中n(CH3COO-)=0.01mol,下列叙述正确的是
A.向该醋酸溶液中加入等体积等浓度的盐酸,抑制醋酸的电离,溶液中c(H+)增大
B.若醋酸溶液体积为1L,则c(CH3COOH)=0.01mol/L
C.与NaOH恰好中和时,溶液中c(Na+)<c(CH3COO-)
D.与等体积等浓度的醋酸钠溶液混合,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-)
参考答案:AD
本题解析:醋酸是弱酸,盐酸是强酸,前者部分电离,后者完全电离,加入等浓度盐酸,增大溶液中氢离子浓度,使CH3OOH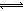 CH3COO—+H+的平衡左移,故A选项正确;由于n(CH3COO-)=0.01mol,说明已经电离的醋酸为0.01mol,则未电离的醋酸远远大于0.01mol,若醋酸溶液体积为1L,则c(CH3COOH)>0.01mol/L,故B选项错误;醋酸与氢氧化钠恰好中和时,溶液中的溶质只有醋酸钠,CH3OONa="=" CH3COO—+Na+,由于钠离子不能水解,醋酸根离子部分水解,则溶液中c(Na+)>c(CH3COO-),故C选项错误;混合溶液呈电中性,含有钠离子、氢离子、氢氧根离子和醋酸根离子,根据电荷守恒原理,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),故D选项正确。
CH3COO—+H+的平衡左移,故A选项正确;由于n(CH3COO-)=0.01mol,说明已经电离的醋酸为0.01mol,则未电离的醋酸远远大于0.01mol,若醋酸溶液体积为1L,则c(CH3COOH)>0.01mol/L,故B选项错误;醋酸与氢氧化钠恰好中和时,溶液中的溶质只有醋酸钠,CH3OONa="=" CH3COO—+Na+,由于钠离子不能水解,醋酸根离子部分水解,则溶液中c(Na+)>c(CH3COO-),故C选项错误;混合溶液呈电中性,含有钠离子、氢离子、氢氧根离子和醋酸根离子,根据电荷守恒原理,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),故D选项正确。
本题难度:一般
4、填空题 (12分)在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解。试回答下列问题:
(1)FeCl2溶液呈?(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):?;实验室在配制FeCl2溶液时,常将FeCl2固体先溶于较浓的盐酸中,以?(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应?。
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是?。
A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
C.丙同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
D.丁同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是?。
参考答案:(1)?酸?Fe2++2H2O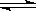 Fe(OH)2+2H+?抑制?
Fe(OH)2+2H+?抑制?
(2)? Al3++3HCO3-=Al(OH)3↓+3CO2↑? (3)? D?(4)Al2O3
本题解析:(1)氯化亚铁是强酸铁弱碱盐,水解显酸性,因此增大氢离子浓度,能抑制其水解。
(2)硫酸铝水解显酸性,碳酸氢钠水解显碱性,所以二者混合时水解相互促进,生成氢氧化铝沉淀和CO2气体。
(3)A不正确,因为中和反应是放热反应。B不正确,硝酸铵溶于水是吸热过程。C不正确,因为是增大了NH4+的浓度,抑制了氨水的电离,所以pH减小。因此选项D是正确,红色加深,说明升高温度,平衡向正反应方向移动,即水解是吸热反应。
(4)氯化铝溶液中存在水解平衡AlCl3+3H2O Al(OH)3+3HCl,加热促进水解,同时生成物氯化氢易挥发,进一步促进水解,所以最终得到的是氢氧化铝沉淀,灼烧得到氧化铝。
Al(OH)3+3HCl,加热促进水解,同时生成物氯化氢易挥发,进一步促进水解,所以最终得到的是氢氧化铝沉淀,灼烧得到氧化铝。
本题难度:简单
5、选择题 相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO溶液的说法中正确的是( )
A.酸的强弱:HCN>HClO
B.pH:HClO>HCN
C.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(CN-)<c(ClO-)
参考答案:D
本题解析:强碱弱酸盐的水溶液呈碱性,相应酸的酸性越弱,其强碱盐溶液的碱性越强。NaCN溶液的pH比NaClO大,说明HCN比HClO酸性弱。
本题难度:一般