时间:2017-08-22 16:05:09
1、填空题 (14分)X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,相关信息如下表:
| 元素 | 相关信息 |
| X | X原子核外最外层电子数是次外层的2倍 |
| Y | Y的气态氢化物的水溶液显弱碱性 |
| Z | Z是地壳中含量最多的金属元素 |
| W | 常温常压下,W的单质是淡黄色固体 |
| Q | …… |
 (1)元素Q在元素周期表中的位置______________________________.
(1)元素Q在元素周期表中的位置______________________________.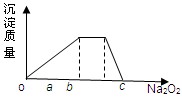
参考答案:(共14分)
(1)第三周期第ⅦA族?(2分)
(2) 2NH3+3H2O2=N2+6H20?(3分)
(3)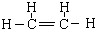 (写CH2=CH2不给分)(2分)
(写CH2=CH2不给分)(2分)
(4) CO(g)+ ?
? O2(g)=CO2(g)?△H=-283.0kJ·mol-1?(3分)
O2(g)=CO2(g)?△H=-283.0kJ·mol-1?(3分)
(5)? 6Na2O2+4Al3++6H2O=4Al(OH)3↓+3O2↑+12Na+?(2分)
2Na2O2+4NH4+=4NH3↑+O2↑+4Na++2H2O?(2分)
本题解析:略
本题难度:一般
2、选择题 A、B、C、D、E为短周期元素组成的中学常见物质,它们转化关系如图所示(部分产物、条件略去).下列说法正确的是( )
A.若C为二氧化碳,则E可以是强碱也可以是强酸
B.若D为白色胶状难溶物,且与A摩尔质量相等,则E为一常见气体单质
C.若E为氢气,则A一定为金属单质钠
D.若A为金属单质,则X一定为二氧化碳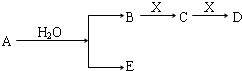
参考答案:B
本题解析:
本题难度:简单
3、填空题 (11分)A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8.
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C元素在周期表中的位置为________________乙与甲的水溶液反应的离子方程式为_______________________________________.
(2)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,该反应的化学方程式为? ______________________
(3)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_____________,1 mol戊与过量盐酸反应的离子方程式是? ________________________?戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是_______________________________________________________________;8 g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375 kJ的热量,写出该反应的热化学方程式
________________________________________________________________
参考答案:(1)第三周期第ⅢA族? Al(OH)3+OH-===AlO+2H2O
(2)2Na2O 2+2H2O===4NaOH+O2↑
2+2H2O===4NaOH+O2↑
(3)? ? ? N2H4+2H+===N2H
? ? N2H4+2H+===N2H 戊中氮元素的化合价为-2价,既可以升高,又可以降低
戊中氮元素的化合价为-2价,既可以升高,又可以降低
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g)ΔH=-1 500 kJ/mo
本题解析:略
本题难度:简单
4、填空题 已知A、B、C、D是中学化学的常见物质,它们在一定条件下有如下转
化关系: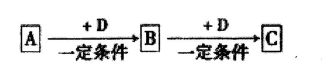
(1)若A为能使湿润的红色石蕊试纸变蓝的气体,C为红棕色气体。则A的空间构型为?,A转化为B反应的化学方程式为?。
(2)若A、B、C均为氧化物,A为砖红色固体,且A中金属元素为+1价,D是一种黑色固态非金属单质,则A的化学式为?,B的电子式为??。
(3)若D为氯碱工业的主要产品,B为高中常见的一种具有两性的物质,则C溶液中除氢氧根外还存在的阴离子的化学式为?。氯碱工业中阴极的电极反应式为?。
参考答案:(1)三角锥 (1分)4NH3+5O2 ?4NO+6H2O?(2分,无条件或未配平各扣1分)
?4NO+6H2O?(2分,无条件或未配平各扣1分)
(2)Cu2O?(1分)? (2分)
(2分)
(3)AlO2-或Al(OH)4-?(1分)? 2H+ +2e-= H2↑或2H2O+2 e-= H2↑+2OH-?(2分)
本题解析:(1)若A为能使湿润的红色石蕊试纸变蓝的气体,则A是氨气,空间构型为三角锥形。C为红棕色气体,则C是NO2。所以D是氧气,B是NO。则A转化为B反应的化学方程式为4NH3+5O2 ?4NO+6H2O。
?4NO+6H2O。
(2)若A、B、C均为氧化物,A为砖红色固体,且A中金属元素为+1价,所以A是氧化亚铜,化学式是Cu2O。D是一种黑色固态非金属单质,则D是碳元素,所以B是CO2,C是CO,则B的电子式为 。
。
(3)若D为氯碱工业的主要产品,B为高中常见的一种具有两性的物质,则A是可溶性铝盐,D是氢氧化钠,B是氢氧化铝,C是偏铝酸钠,因此C溶液中除氢氧根外还存在的阴离子的化学式为AlO2-或Al(OH)4-。电解池中阴极得到电子,则是溶液中的氢离子放电,所以氯碱工业中阴极的电极反应式为 2H+ +2e-= H2↑。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:困难
5、简答题 如图所示,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色.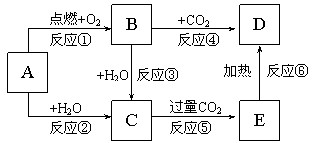
请填写下列空白:
(1)写出反应②的实验现象______.
(2)以上反应中属于氧化还原反应的有______.(填写编号)
(3)反应②的离子反应方程式______;
反应⑥的化学方程式______.
向D中滴入少量盐酸的化学方程式______.
参考答案:A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色,则均为钠的单质或化合物,所以A为Na,结合转化关系可知,B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3,
(1)反应②为Na与水的反应,实验现象为浮、熔、游、响,故答案为:浮、熔、游、响;
(2)以上反应中①为钠的燃烧,②为Na与水反应,③为过氧化钠与水反应,④为过氧化钠与二氧化碳反应,均属于氧化还原反应,故答案为:①②③④;
(3)反应②的离子反应为2Na+2H2O═2Na++2OH-+H2↑,反应⑥为2NaHCO3?△?.?Na2CO3+CO2↑+H2O,D中加少量盐酸的反应为Na2CO3+HCl═NaHCO3+NaCl,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;2NaHCO3?△?.?Na2CO3+CO2↑+H2O;Na2CO3+HCl═NaHCO3+NaCl.
本题解析:
本题难度:一般