时间:2017-08-22 16:00:45
1、填空题 1932年捷克的Landa等人从南摩拉维亚油田的石油分馏 物中发现一种烷(代号A),次年用X-射线技术证实了其结构,竟是一个叫Lukess的人早就预言过的。后来A被大量合成,并发现它们胺类衍生物具有抗病毒、抗震颤的药物活性而开发为常用药。如图给出三种已经合成的2,3,4个A为基本结构单元模块,像搭积木一样“搭”成的较复杂笼状火烷。根据上述条件推断填空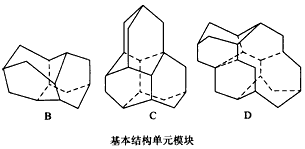
(1)B的分子式________。
(2)若在D上继续增加一“块”A“模块”得到E,则E的分子式为__________。
(3)A中含有的六元环数为________个,其中有________个碳原子为三环所共有,这几个碳原子所围成的空间几何形状为________。
参考答案:(1)C14H20
(2)C26H32
(3)4;4;四面体
本题解析:
本题难度:一般
2、选择题 下列说法正确的是(NA为阿伏加德罗常数)( )
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为1.5NA
C.12 g金刚石中含有C—C键的个数为4NA
D.60gSiO2中含Si—O键的个数为2NA
参考答案:B
本题解析:白磷是正四面体型结构,则124 g P4含有P—P键的个数为6NA,A不正确;石墨是层状结构,每个碳原子均被3个正六边形共用,所以平均1个碳原子形成1.5个碳碳单键,所以选项B正确;金刚石中平均1个碳原子形成4÷2=2个碳碳单键,所以选项C不正确;二氧化硅晶体中,平均1个硅原子形成4个Si—O键,则.60gSiO2中含Si—O键的个数为4NA,D不正确,答案选B。
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
3、选择题 通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示,下列关于这些晶体结构和性质的叙述不正确的是? ( )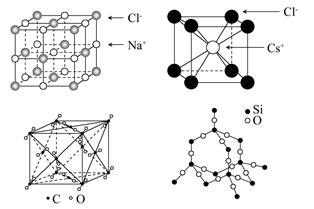
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键
参考答案:B
本题解析:SiO2和CO2的化学式相似,但其晶体结构不同,A项正确;二氧化碳为分子晶体,因此分子间存在分子间作用力,而分子内部碳原子和氧原子间形成共价键,氯化钠和氯化铯为离子晶体,所以物理性质不同。根据二氧化硅的结构可判断D项正确。
本题难度:一般
4、填空题 图为甲、乙、丙三种离子晶体的晶胞(晶体中最小的重复单元)结构,在甲晶体中X处于晶胞中心,乙中A处于晶胞中心。请推知:甲晶体中X与Y的个数比是_____。乙晶体中A与B的个数比是______。丙品体的一个晶体中有个C离子,有_______个D离子。 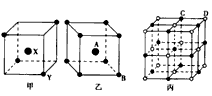
参考答案:2:1;1:1;4
本题解析:
本题难度:一般
5、推断题 有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88. 9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫_____,其晶体类型是________。B的氢化物的电子式为 _____________,属________(填“极性”或“非极性”)分子。
(2)A和B形成化合物的分子空间构型为_______,属________分子(填“极性”或“非极性”),其晶体类型是___________。
(3)C元素位于周期表中第____周期_____族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)_____________。
(4)C和D的化合物溶于水后滴入过量KOH,现象是__________,离子方程式_______________________。
参考答案:(1)金刚石;原子晶体;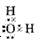 ?;极性
?;极性
(2)直线形分子;非极性;分子晶体
(3)3;ⅢA;HClO4>H2CO3>Al(OH)3
(4)先有白色沉淀,滴入过量KOH时白色沉淀消失; Al3++3OH-=Al(OH)3↓? Al(OH)3+OH-= AlO2-+2H2O
本题解析:
本题难度:一般