时间:2017-08-22 15:43:22
1、选择题 下列物质的稀水溶液中,除水分子外,不存在其它分子的是
A.NH4Cl
B.NaHSO3
C.HNO3
D.HClO
参考答案:C
本题解析:NH4Cl水解出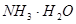 ,故A错误;NaHSO3水解出
,故A错误;NaHSO3水解出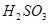 ,故B错误;HNO3为强电解质,故C正确;HClO为弱电解质,含有HClO分子,故D错误。
,故B错误;HNO3为强电解质,故C正确;HClO为弱电解质,含有HClO分子,故D错误。
考点:本题考查弱电解质电离和盐的水解。
本题难度:一般
2、选择题 常温下,向一定浓度的醋酸溶液中逐滴加入氢氧化钠溶液直至过量,在此操作过程中,有关溶液中离子浓度变化的大小关系不正确的是
A.当pH=7时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
B.当pH>7时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.当恰好完全中和时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.反应全程都有关系:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
参考答案:B
本题解析:
本题难度:一般
3、选择题 将NaOH溶液逐滴加入到醋酸溶液中,使溶液为中性,则此时
A.c(CH3COO-)=c(Na+)
B.c(CH3COO-)>c(Na+)
C.c(CH3COO-)<c(Na+)
D.c(CH3COO-)与c (Na+)之间关系不确定
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是
A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小
C.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+)
D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
参考答案:A
本题解析:A、HCl溶液中氢离子的物质的量小于氢氧化钡溶液中氢氧根离子的物质的量,所以溶液显碱性,则溶液中氢氧根离子的浓度=(10×2-10)mL×0.02mol/L/20mL=0.01mol/L,则氢离子的浓度是10-12mol/L,所以溶液的pH=12,正确;B、Ksp也是平衡常数,isUI温度变化而变化,但温度不变,溶度积不变,错误;C、醋酸钠溶液中,醋酸根离子水解生成醋酸和氢氧根离子,所以根据质子守恒,c(OH-)=c(CH3COOH)+c(H+),错误;D、常温下pH=4的NaHC2O4溶液为酸性溶液,则HC2O4-的电离程度大于其水解程度,电离产生C2O42-,水解产生H2C2O4,所以c(H2C2O4)<c(C2O42-),错误,答案选A。
考点:考查酸碱混合pH的计算,溶度积的判断,电解质溶液中离子浓度的判断
本题难度:一般
5、选择题 要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是
A.MgO
B.MgCO3
C.NaOH
D.Mg(OH)2
参考答案:C
本题解析:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则,据此可以判断。A、氧化镁能消耗溶液中的氢离子,降低溶液的酸性,进而可以生成氢氧化铁沉淀,且不会引入新的杂质,A正确;B、碳酸镁能消耗溶液中的氢离子,降低溶液的酸性,进而可以生成氢氧化铁沉淀,且不会引入新的杂质,B正确;C、氢氧化钠能消耗溶液中的氢离子,使铁离子转化为氢氧化铁沉淀。但同时又引入了新的杂质钠离子,C不正确;D、氢氧化镁能消耗溶液中的氢离子,降低溶液的酸性,进而可以生成氢氧化铁沉淀,且不会引入新的杂质,D正确,答案选C。
考点:考查物质除杂的有关判断
本题难度:一般