时间:2017-08-22 15:26:30
1、选择题 下列关于盐酸与醋酸两种稀溶液的说法正确的是(?)
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小
参考答案:B
本题解析:盐酸是强酸,醋酸是弱酸,在浓度相同的条件下,盐酸中氢离子浓度大,A不正确。B中盐酸和醋酸的物质的量相同,所以中和碱的能力是相同的,B正确。稀释有利于电离,所以C中醋酸的pH小于5,不正确。盐酸没有电离平衡,加入钠盐。不用影响氢离子的浓度,D不正确。答案选B。
本题难度:简单
2、选择题 25℃时在五份蒸馏水中分别加入适量的下列物质,所得实验结果如下表所示:
| 加入物质 | HCl(aq) | FeCl3 | NaOH | HCOONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未测定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
参考答案:B
本题解析:略
本题难度:一般
3、填空题 将pH=13和pH=11的氢氧化钠溶液等体积混合,求混合后溶液的pH= ?。
参考答案:12.7
本题解析:略
本题难度:简单
4、选择题 下列有关溶液pH的说法正确的是( )
A.将pH=11的氢氧化钠溶液加水稀释100倍,溶液中c(H+)=10-13mol/L
B.将pH=9的氢氧化钠溶液和pH=13的氢氧化钡溶液等体积混合,所得混合溶液的pH=11
C.将pH=1的硫酸溶液和pH=5的盐酸等体积混合,所得混合溶液的pH=1.3
D.pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,由于氢氧化钡过量,所得溶液的pH>7
参考答案:C
本题解析:pH=11的氢氧化钠溶液加水稀释100倍,pH=9,所以溶液中c(H+)=10-9mol/L,故A错误;pH=9的氢氧化钠溶液中c(OH-)=10-5mol/L,和pH=13的氢氧化钡溶液中c(OH-)=10-1mol/L,所以两者混合后的c(OH-)=(10-5+10-1)/2≈0.05,
所以c(H+)=10-14/0.05=2×10-13mol/L,所以pH=-lgc(H+)=12.7,故B错误;pH=1的硫酸溶液中,c(H+)=10-1mol/L,pH=5的盐酸中,c(H+)=10-5mol/L,所以两者混合后的c(H+)=(10-5+10-1)/2≈0.05, pH=-lgc(H+)=1.3,故C正确;pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,氢氧化钡刚好与盐酸完全反应,所以所得溶液的pH为7,故D错误。
点评:本题考查溶液pH的计算,有一定的综合性,该题有一定的难度。
本题难度:一般
5、选择题 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应。下列说法不正确的是?
A.所用醋酸溶液的浓度大于所用氢氧化钠溶液的浓度
B.两溶液混合反应后的所得的混合溶液呈碱性
C.原醋酸溶液中有1%的醋酸已电离
D.反应后的溶液中CH3OO-与CH3COOH两种微粒的平衡浓度之和为0.05mol?L-1
参考答案:A
本题解析:醋酸溶液与氢氧化钠溶液等体积混合后恰好完全反应,由于二者是一元酸与一元碱的反应,所以醋酸与氢氧化钠溶液的浓度应该相等,A错误;恰好完全反应所得的溶液应该是醋酸钠溶液,由于醋酸根离子发生水解所以溶液呈碱性,B正确;假设体积均为1L,所以可以计算出混合前醋酸的浓度为0.1mol?L-1,根据其PH可以计算出电离出的氢离子浓度为0.001mol?L-1,醋酸的电离度为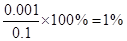 ,根据物料守恒可以得出反应前后醋酸根与醋酸分子的总的物质的量不发生变化,总的物质的量为0.1moL,等体积混合后体积变为原来的两倍,所以浓度变为原来的一半为0.05mol?L-1所以只有A错误,答案选A。
,根据物料守恒可以得出反应前后醋酸根与醋酸分子的总的物质的量不发生变化,总的物质的量为0.1moL,等体积混合后体积变为原来的两倍,所以浓度变为原来的一半为0.05mol?L-1所以只有A错误,答案选A。
本题难度:一般