时间:2017-08-22 15:01:02
1、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量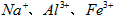 等杂质)生产医药级二水合氯化钙(
等杂质)生产医药级二水合氯化钙(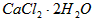 的质量分数为97.0%~103.0%)的主要流程如下
的质量分数为97.0%~103.0%)的主要流程如下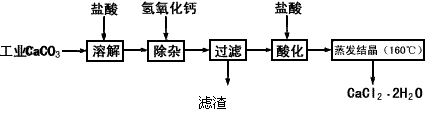
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量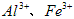 。检验
。检验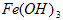 是否沉淀完全的试验操作是___________________。
是否沉淀完全的试验操作是___________________。
(2)酸化操作是加入盐酸,调节溶液的约pH为4.0,其目的有:
①将溶液中少量的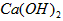 转化为
转化为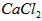 ;
;
②防止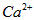 在蒸发时水解;
在蒸发时水解;
③___________________。
(3)测定样品中 含量的方法是:
含量的方法是:
a.称取0.7500g样品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用0.05000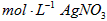 溶液滴定至终点,消耗
溶液滴定至终点,消耗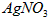 溶液体积的平均值为20.39mL。
溶液体积的平均值为20.39mL。
①上述测定过程中需要溶液润洗的仪器有___________________。
②计算上述样品中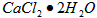 的质量分数为___________________。
的质量分数为___________________。
③若用上述办法测定的样品中 的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。
的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。
参考答案:(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3沉淀完全
(2)防止溶液吸收空气中CO2
(3)①酸式滴定管;②99.9%;③样品中存在少量的NaCl;少量的CaCl2·2H2O失水
本题解析:
本题难度:一般
2、实验题 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。提出问题: Fe3+、Br2谁的氧化性更强?
(1)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含
_________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含_________所致。
(2)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。供选用的试剂:
a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到得现象。(试剂填序号) 
(3)结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为:________________________。
(4)实验后的思考:
①根据实验推测,若在溴化亚铁溶液中通入氯气,首先氧化的离子是____________(填离子符号)。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则该反应的离子方程式的为___________________,原FeBr2溶中FeBr2的物质的量浓度为_________________。
参考答案:(1)①Br2;②Fe3+
(2)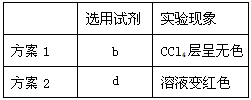 (3)2Fe2++Br2==2Fe3++2Br-
(3)2Fe2++Br2==2Fe3++2Br-
(4)①Fe2+;②2Fe2++2Br-+2Cl2==2Fe3++Br2+4Cl-;1mol·L-1
本题解析:
本题难度:困难
3、实验题 (10分)实验室用固体烧碱配制100 mL? 1.0 mol·L-1的NaOH溶液。
A.100 mL烧杯
B.500 mL容量瓶
C.玻璃棒
D.100 mL容量瓶 E、漏斗
F、胶头滴管? G、试管? H、托盘天平? I、药匙 J、200 mL试剂瓶
(1)需称量_________ g 烧碱,应放在___________中(填写代号)称量、溶解。
(2)完成此配制实验,需要用的仪器(填写代号)___________________
参考答案: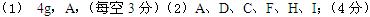
本题解析:略
本题难度:一般
4、选择题 下列能达到实验目的的是
参考答案:B
本题解析:略
本题难度:一般
5、简答题 下面是提纯大理石(主要杂质是氧化铁)的流程图: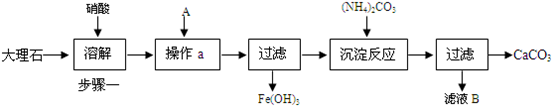
按要求回答下列问题:
(1)为加快步骤一中的固体溶解,可采取的措施有______把工业大理石研成粉末(只写一点).
(2)操作a中A物质最好应选择______(填化学式).在该过程中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是______.
(3)检验Fe3+已完全生成Fe(OH)3沉淀的方法是:______.
(4)若将滤液B中的溶质回收再用,除了得到NaNO3外,还可能得到______(填化学式).
参考答案:由流程可知,大理石、氧化铁和硝酸反应,固体溶解,为除去杂质,A为碱,试剂A为NaOH与铁离子反应生成沉淀,过滤得到Fe(OH)3沉淀,滤液中主要含硝酸钙,然后加碳酸铵反应生成碳酸钙,则滤液B中还有NaOH、(NH4)2CO3,
(1)接触面积增大,反应速率加快,则把工业大理石研成粉末(或搅拌等),故答案为:把工业大理石研成粉末;
(2)由上述分析可知,A的作用为将铁离子转化为沉淀,则A应加入碱,最好为NaOH;测定pH的操作为取一小块pH试纸放在洁净的玻璃片上,用玻璃棒沾取少量待测溶液点在pH试纸中部,变色后和标准比色卡对比,读出pH,
故答案为:NaOH;取一小块pH试纸放在洁净的玻璃片上,用玻璃棒沾取少量待测溶液点在pH试纸中部,变色后和标准比色卡对比,读出pH;
(3)铁离子遇KSCN溶液变为血红色,则检验Fe3+已完全生成Fe(OH)3沉淀的方法是取上层清液(或滤液),滴加几滴KSCN溶液,如果溶液颜色不变,则说明Fe3+沉淀完全,如果变红,则说明没有沉淀完全,
故答案为:取上层清液(或滤液),滴加几滴KSCN溶液,如果溶液颜色不变,则说明Fe3+沉淀完全,如果变红,则说明没有沉淀完全
(4)由上述分析可知,沉淀铁离子时NaOH可能过量,沉淀钙离子加入的(NH4)2CO3可能过量,则滤液B中的溶质回收再用,除了得到NaNO3外,还可能得到NaOH、(NH4)2CO3,
故答案为:NaOH、(NH4)2CO3.
本题解析:
本题难度:简单