时间:2017-08-22 14:25:40
1、填空题 (1)科学家通过X射线推测胆矾结构示意图可简单表示如下,图中虚线表示的作用力分别为?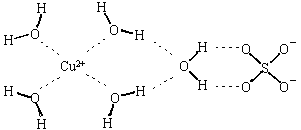
(2)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式:?;
(3)SiCl4与SO42一互为等电子体,预测SO42一的空间构型为??
2、填空题 (14分)
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。
请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序?。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是?。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a?b(填“大于”、“小于”、“等于”),理由是?
?
| 元素 | Mn | F | |
| 电离能 ( 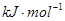 ) ) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | a | b | |
| ? | 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
3、选择题 下列叙述中不正确的是
[? ]
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强
B.以极性键结合的分子,一定是极性分子
C.判断A2B或AB2型分子是否是极性分子的依据是具有极性键且分子构型不对称,键角小于 180°的非直线形结构
D.非极性分子中,各原子间都应以非极性键结合
4、选择题 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3(如下图所示)。已知该分子中N–N–N键角都是108.1°。下列有关N(NO2)3的说法正确的是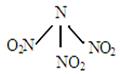 ?
?
A.分子中N、O原子间形成的共价键是非极性键
B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性
D.分子中四个氮原子围成一个空间正四面体
5、填空题 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为?,该元素的符号是?。
(2)Y元素原子的电子排布图为?,元素X与Y的电负性比较:X?Y(填“>”或“<”)。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为?。
(4)由元素X与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构如图所示。(黑球位于立方体内,白球位于立方体顶点和面心)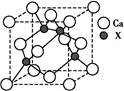
请写出化合物A的化学式?;化合物A可由(CH3)3Ga和AsH3在700 ℃下反应制得,反应的化学方程式为?。
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为?。