时间:2017-08-22 14:14:24
1、选择题 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3 kJ/mol;辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
[? ]
A.CH3COOH(aq)+NaOH(aq)=== CH3COONa(aq)+H2O(l) △H=57.3kJ/mol
B.KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l) △H=57.3kJ/mol
C.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1) △H=11036 kJ/mol
D.C8H18(l)+ 25/2O2(g)=8CO2(g)+ 9H2O(g) △H=5518kJ/mol
参考答案:BC
本题解析:
本题难度:简单
2、选择题 下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A.NH3(g)+O2(g)  NO(g)+H2O(g) ΔH="-a" kJ·mol-1
NO(g)+H2O(g) ΔH="-a" kJ·mol-1
B.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l) ΔH="-b" kJ·mol-1
6CO2(g)+6H2O(l) ΔH="-b" kJ·mol-1
C.2CO(g)+O2(g) 2CO2(g) ΔH="-c" kJ·mol-1
2CO2(g) ΔH="-c" kJ·mol-1
D.CH3CH2OH(l)+O2(g) CH3CHO(l)+H2O(l) ΔH="-d" kJ·mol-1
CH3CHO(l)+H2O(l) ΔH="-d" kJ·mol-1
参考答案:B
本题解析:根据燃烧热的定义:在25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物所放出的热量,叫该物质的燃烧热。A中水为气态,C中CO为2 mol,D中产物中应生成CO2,故B正确。
本题难度:一般
3、选择题 某温度下,已知醋酸的电离常数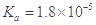 ,醋酸银的溶度积
,醋酸银的溶度积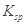 (CH3COOAg )=1.6×10
(CH3COOAg )=1.6×10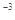 ,
,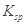 (Ag2CO3)="8.3"
(Ag2CO3)="8.3" 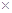 l0
l0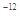 。在不考虑盐类水解的情况下,下列有关说法正确的是
。在不考虑盐类水解的情况下,下列有关说法正确的是
A.醋酸水溶液中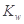 不变,故醋酸对水的电离无影响
不变,故醋酸对水的电离无影响
B.该温度下饱和醋酸水溶液的pH =5-lgl.8
C.该温度下浓度均为0.01 mol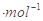 的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成
的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成
D.将0.02 mol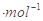 的Na2CO3,溶液与CH3COOAg沉淀上清液等体积混合,出现白色沉淀
的Na2CO3,溶液与CH3COOAg沉淀上清液等体积混合,出现白色沉淀
参考答案:D
本题解析:A水是弱电解质,存在电离平衡H2O H++OH-。当向水中加入CH3COOH时,醋酸电离产生的H+使溶液中的H+浓度增大,对水的电离平衡起到了抑制作用。错误。B.PH为溶液中c(H+)的负对数。
H++OH-。当向水中加入CH3COOH时,醋酸电离产生的H+使溶液中的H+浓度增大,对水的电离平衡起到了抑制作用。错误。B.PH为溶液中c(H+)的负对数。 .
.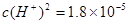 ;
; .所以pH="3-" lg
.所以pH="3-" lg 。错误。C.若二者等体积混合,则c(CH3COO-)·c(Ag+)=" 0.005mol/L×0.005mol/L=" 2.5×10-5 mol2/L2 <1.6×10-3=醋酸银的溶度积Ksp (CH3COOAg ).因此不会有CH3COOAg沉淀生成。错误。D.若将0.02 mol/L的Na2CO3溶液与CH3COOAg沉淀上清液等体积混合,c(CO32-)="0.01mol/L;" c(Ag+)=" 1/2×4" ×10-2 mol/L=2×10-2mol/L. c(CO32-)·c(Ag+)2=0.01mol/L×(2×10-2mol/L)2=4×10-6mol3/L3>8.3 ×l0-12.因此会出现Ag2CO3白色沉淀。正确。
。错误。C.若二者等体积混合,则c(CH3COO-)·c(Ag+)=" 0.005mol/L×0.005mol/L=" 2.5×10-5 mol2/L2 <1.6×10-3=醋酸银的溶度积Ksp (CH3COOAg ).因此不会有CH3COOAg沉淀生成。错误。D.若将0.02 mol/L的Na2CO3溶液与CH3COOAg沉淀上清液等体积混合,c(CO32-)="0.01mol/L;" c(Ag+)=" 1/2×4" ×10-2 mol/L=2×10-2mol/L. c(CO32-)·c(Ag+)2=0.01mol/L×(2×10-2mol/L)2=4×10-6mol3/L3>8.3 ×l0-12.因此会出现Ag2CO3白色沉淀。正确。
本题难度:一般
4、选择题 对于常温下pH= 3的乙酸溶液,下列说法正确的是
A.c(H+)=c(CH3COO-)+c(OH-)
B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH降低
D.与等体积pH=11的NaOH溶液混合后所得溶液中c(Na+)=c(CH3COO-)
参考答案:A
本题解析:乙酸溶液中乙酸和水都能部分电离,则溶液中存在氢离子、乙酸根离子、氢氧根离子,由于电解质溶液呈电中性,则c(H+)=c(CH3COO-)+c(OH-),故A正确;pH=3,则溶液中c(H+)=1.0×10-3 mol·L-1,稀释10倍后溶液中c(H+)不是1.0×10-4 mol·L-1,因为乙酸在水中存在电离平衡,稀释能使CH3COOH H++CH3COO-平衡向电离方向移动,促进乙酸电离,所以稀释10倍后溶液中c(H+)大于1.0×10-4 mol·L-1,因此溶液pH<4,故B错误;乙酸钠是溶于水完全电离的强电解质,加入少量乙酸钠固体,增大乙酸根离子浓度,使CH3COOH
H++CH3COO-平衡向电离方向移动,促进乙酸电离,所以稀释10倍后溶液中c(H+)大于1.0×10-4 mol·L-1,因此溶液pH<4,故B错误;乙酸钠是溶于水完全电离的强电解质,加入少量乙酸钠固体,增大乙酸根离子浓度,使CH3COOH H++CH3COO-平衡向逆反应方向移动,则溶液中氢离子减小,由于pH="—lg" c(H+),所以溶液的pH增大或升高,故C错误;氢氧化钠溶液中c(OH-)=Kw/c(H+)=Kw/10-pH="0.001" mol·L-1,乙酸溶液中c(H+)=1.0×10-3 mol·L-1,由于n=c?V,则混合前氢氧化钠溶液中氢氧根离子的物质的量等于乙酸溶液中氢离子的物质的量,二者混合时H+与OH-发生中和反应,氢氧化钠是强电解质,不可能继续电离出氢氧根离子,而乙酸是弱电解质,随着氢离子的消耗,CH3COOH
H++CH3COO-平衡向逆反应方向移动,则溶液中氢离子减小,由于pH="—lg" c(H+),所以溶液的pH增大或升高,故C错误;氢氧化钠溶液中c(OH-)=Kw/c(H+)=Kw/10-pH="0.001" mol·L-1,乙酸溶液中c(H+)=1.0×10-3 mol·L-1,由于n=c?V,则混合前氢氧化钠溶液中氢氧根离子的物质的量等于乙酸溶液中氢离子的物质的量,二者混合时H+与OH-发生中和反应,氢氧化钠是强电解质,不可能继续电离出氢氧根离子,而乙酸是弱电解质,随着氢离子的消耗,CH3COOH H++CH3COO-平衡向电离方向移动,乙酸能继续电离出氢离子,所以混合后氢氧化钠溶液中氢氧根离子的物质的量小于乙酸溶液中氢离子的物质的量,则氢离子过量,所得溶液显酸性,c(H+)>c(OH-),混合溶液存在氢离子、钠离子、乙酸根离子和氢氧根离子,根据电荷守恒原理,则c(H+)+ c(Na+)= c(CH3COO-)+ c(OH-),由于,c(H+)>c(OH-),则c(Na+)<c(CH3COO-),故D错误。
H++CH3COO-平衡向电离方向移动,乙酸能继续电离出氢离子,所以混合后氢氧化钠溶液中氢氧根离子的物质的量小于乙酸溶液中氢离子的物质的量,则氢离子过量,所得溶液显酸性,c(H+)>c(OH-),混合溶液存在氢离子、钠离子、乙酸根离子和氢氧根离子,根据电荷守恒原理,则c(H+)+ c(Na+)= c(CH3COO-)+ c(OH-),由于,c(H+)>c(OH-),则c(Na+)<c(CH3COO-),故D错误。
本题难度:简单
5、选择题 下列操作对滴定结果无影响的是(?)
A.盛待测液的锥形瓶先用待测液润洗
B.滴定管尖嘴部分有气泡,滴定结束后气泡消失
C.滴定管在滴定前液面在0刻度以下
D.达到滴定终点时俯视读取滴定管内液体体积
参考答案:C
本题解析:锥形瓶不能用待测液洗涤,否则浓度偏大,A不正确。B中相当于标准液的体积偏多,测定结果偏高,B不正确。俯视读数滴定管,读数偏低,测定结果偏低,答案选C。
本题难度:一般