时间:2017-08-22 13:59:57
1、选择题 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出正确选项( )
| 锥形瓶中液体 | 滴定试管中液体 | 选用指示剂 | 选用滴定管 ① 碱 酸 石蕊 (乙) ② 酸 碱 酚酞 (甲) ③ 碱 酸 甲基橙 (甲) ④ 酸 碱 酚酞 (乙) |
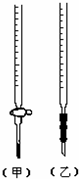
参考答案:CD
本题解析:
本题难度:简单
2、选择题 下列实验装置(部分固定装置略去)和有关叙述正确的是( )
A.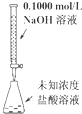
可以进行酸碱中和滴定实验
B.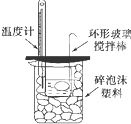
可以进行中和热的测定实验
C.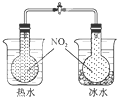
可验证温度对化学平衡的影响
D.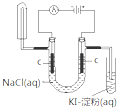
可检验食盐水通电后的部分产物
参考答案:CD
本题解析:
本题难度:一般
3、实验题 下图是用0.1000?mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答: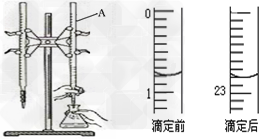
⑴?仪器A的名称是_________;
⑵?盐酸的体积读数:滴定前读数为_______?mL,滴定后读数为________mL;
⑶?某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的浓度是_____________(保留四位有效数字)? 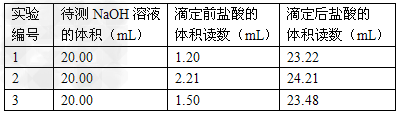
⑷判断到达滴定终点的实验现象是_____________________。
⑸对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果未用标准溶液润洗酸式滴定管,对测定结果的影响是______________;
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是_______________;
③标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是_______________。
参考答案:(1)酸式滴定管?
(2)0.80;22.80
(3)0.1100mol/L?
(4)溶液恰好由粉红色(或红色)变为无色,且半分钟内不褪色
(5)①偏高;②无影响;③偏低
本题解析:
本题难度:一般
4、简答题 滴定法是化学定量分析的一种重要而普遍的方法.
I:如图是常温下用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1某一元酸HX溶液所得滴定曲线.
请回答下列问题:
(1)若学生分组实验需用约400mL0.1000mol?L-1NaOH溶液,配制所需溶液时必需的定量玻璃仪器是______.
(2)判断HX是______(填“强酸”或“弱酸”),理由是______
(3)点①所示溶液中,各离子浓度由大到小的顺序是______.
II:某校化学探究小组用高锰酸钾滴定法测定市场上某品牌钙补品中钙的含量.测定的步骤如下:
①取10.00mL样品,加入适量盐酸酸化,再加入足量的沉淀剂草酸铵[(NH4)2C2O4]溶液,然后慢慢滴加氨水,并调节溶液pH至3.5~4.5之间,产生草酸钙沉淀;
②将沉淀放置过夜或加热半小时使沉淀陈化,过滤、洗涤;
③将洗净的沉淀溶解于适量稀硫酸中,加热至75℃~85℃,用0.1000mol?L-1高锰酸钾溶液滴定至终点,记录消耗的高锰酸钾溶液体积;
④重复上述①~③操作,有关数据记录如表.
实验
样品体积/mL
高锰酸钾溶液体积/mL
1
10.00
8.98
2
10.00
8.58
3
10.00
9.02
4
10.00
9.00
(1)判断滴定终点的现象是______.
(2)写出滴定时所发生反应的离子方程式______.
(3)计算样品中钙的含量______g/L.
(4)下列操作会使测量结果偏低的是______.
a.滴定前俯视读数,滴定后仰视读数
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体.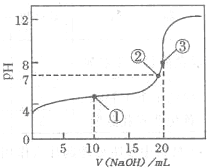
参考答案:Ⅰ:(1)配制溶液时一定用到容量瓶,实验需用约400mL,应用500mL容量瓶,故答案为:500mL容量瓶;
(2)酸的浓度为0.1000?mol?L-1,由图象可以看出0.1000mol?L-1一元酸HX溶液的PH>1,当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,都可以说明HX为弱酸,
故答案为:弱酸;当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,或从图中可看出0.1000?mol?L-1?HX的pH大于1;
(3)点①所示溶液中,酸过量,溶液呈酸性,则溶液中存在c(H+)>c(OH-),
根据溶液电中性:c(H+)+c(Na+)=c(X-)+c(OH-),则c(X-)>c(Na+),且c(Na+)>c(H+),
故有c(X-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(X-)>c(Na+)>c(H+)>c(OH-);
Ⅱ:(1)滴定终点,溶液颜色变化,且半分钟内颜色不变,该反应中当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,
故答案为:当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色;
(2)高锰酸钾与草酸发生氧化还原反应,反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(3)第2组数据误差较大,舍去,根据其它三组数据计算,高锰酸钾溶液的平均体积为:8.98+9.02+9.003mL=9.00mL,
5CaC2O4~5H2C2O4~2MnO4-
5mol?5mol? 2mol?
n?0.1mol/L×9×10-3L?
n=2.25×10-3mol,
则m(Ca2+)=2.25×10-3mol×40g/mol=0.09g,
所以1L样品中含有0.09g×1000mL10mL=9.00g,
故答案为:9.00;
(4)a.滴定前俯视读数,滴定后仰视读数,会导致体积偏大,测量结果偏大,故a错误;
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外,会导致所需标准液偏小,故b正确;
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液,会导致体积读数偏大,测量结果偏大,故c错误;
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体,会导致所需标准液偏小,故d正确.
故答案为:b、d.
本题解析:
本题难度:一般
5、选择题 用已知浓度的强酸滴定未知浓度的强碱溶液时,会导致待测碱液浓度结果偏低的操作是
[? ]
A.锥形瓶用蒸馏水洗净后装待测液
B.滴定管用蒸馏水洗净后注入标准液
C.滴定前仰视读数, 滴定后俯视读数
D.配制碱液时, 称量后固体吸湿
参考答案:C
本题解析:
本题难度:简单