时间:2017-08-10 02:53:18
1、选择题 将C(H+)=1×10-2mol·L-1的CH3COOH和HNO3溶液分别稀释100倍,稀释后两溶液的H+的物质的量浓度分别为a和b,则a和b的关系为
[? ]
A.a>b
B.a<b
C.a=b
D.不能确定
参考答案:A
本题解析:
本题难度:一般
2、选择题 常温下,0.1mol?L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
A.该溶液中水电离出的c(H+)=1×10-10mol?L-1
B.该溶液中c(H+)+c(A-)+c(HA)=0.1mol?L-1
C.该溶液与0.05mol?L-1NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
参考答案:A、溶液中c(OH-)/c(H+)=1×10-8,Kw=C(H+)?C(OH-)=1×10-14,两式中的氢离子浓度是溶液中酸电离出的,氢氧根离子浓度是水电离出的,联立解得C(H+)=0.001mol/L,确定为弱酸溶液,所以溶液中C(OH-)=10-11mol/L,即水电离出的氢离子浓度为10-11mol/L;故A错误;
B、0.1mol?L-1某一元酸(HA)溶液中存在电离平衡,所以根据物料守恒可知c(A-)+c(HA)=0.1mol?L-1,所以c(H+)+c(A-)+c(HA)=0.1mol?L-1是错误的,故B错误;
C、0.1mol?L-1某一元酸(HA)溶液与0.05mol?L-1NaOH溶液等体积混合后反应,反应后的溶液为等浓度的酸HA和盐NaA的混合液,溶液中一定存在电荷守恒;[H+]+[Na+]=[OH-]+[A-],按照选项中的离子浓度大小,若c(A-)>c(Na+),根据电荷守恒应有c(OH-)<c(H+),故C错误;
D、通过计算可知酸为弱酸存在 电离平衡HA?H++A-,加水稀释促进电离,氢离子浓度减小,加入一定量NaA晶体,溶解生成的A-离子抑制了酸的电离,氢离子浓度减小,根据温度一定时溶液中氢离子浓度与氢氧根离子浓度乘积为常数,加入水和加入一定量NaA晶体,使氢离子浓度减小,氢氧根离子浓度增大,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 PH=2的两种一元酸x和y,体积均为100ml,稀释过程中PH与溶液体积的关系如图所示,分别滴加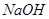 溶液(c=0.1
溶液(c=0.1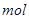 /L)至PH=7,消耗
/L)至PH=7,消耗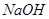 溶液的体积为Vx,Vy,则
溶液的体积为Vx,Vy,则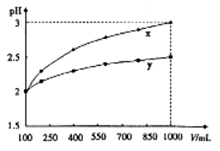
A.x为弱酸Vx<Vy
B.x为强酸Vx>Vy
C.y为强酸Vx>Vy
D.y为弱酸Vx<Vy
参考答案:D
本题解析:酸稀释过程中溶液的PH与稀释的关系为:
若为强酸,加水稀释至原溶液体积的10n倍,PH增加n个单位;
若为弱酸,加水稀释至原溶液体积的10n倍,PH增加的单位数少于n。
注:无论是强酸还是弱酸,无论稀释多少倍溶液PH均小于7。
由图分析,当加水稀释至原溶液体积的10倍时,X酸的PH由2增大为3,即X为一元强酸;而Y酸PH变化少于1介于2、3之间,所以Y酸为一元弱酸。
等体积等PH的一元强酸与一元弱酸,弱酸的物质的量过量,中和NaOH溶液,消耗的NaOH的物质的量更多。
综上所述,正确确答案为D。
本题难度:一般
4、填空题 (1)将等质量的Zn粉分别投入:试管A: 10mL 0.1mol·L-1 HCl和试管B: 10mL 0.1mol·L-1醋酸中: 开始时,反应速率A?B(填>,=或<,下同),若Zn过量,产生H2的体积A?B。
(2)将等质量Zn粉分别投入pH=1体积均为10mL的试管A: 盐酸和试管B: 醋酸中: 开始时,反应速率A?B(填>,=或<,下同),若Zn过量,产生H2的体积A?B。
参考答案:1)>、=?(2)= 、<
本题解析:(1)与锌反应的速率与电离出的氢离子浓度有关,等物质的量浓度的强酸和弱酸,强酸电离出的氢离子浓度大于弱酸电离出的氢离子浓度,所以开始反应速率A>B,与过量的锌反应产生H2的体积与酸的物质的量有关,强酸和弱酸的物质的量相等,所以产生氢气的体积A=B。(2)pH相同的强酸和弱酸,强酸的物质的量浓度小于弱酸的物质的量浓度,所以刚开始反应速率A=B,与过量Zn反应,产生H2的体积A<B。
点评:一元强酸和一元弱酸比较主要从相同物质的量浓度相同体积和相同pH相同体积两方面进行比较。
本题难度:一般
5、选择题 下列事实中,能说明HNO2是弱电解质的是
A.用HNO2溶液做导电性实验,灯泡较暗
B.HNO2是共价化合物
C.HNO2溶液不与NaCl反应
D.室温下,0.1mol·L-1 HNO2溶液的pH为2.15
参考答案:D
本题解析:A项没有用强酸在相同条件下进行对照,错误;B项电解质的强弱与共价化合物无直接关系,错误;C项在一般情况下强酸也不与NaCl反应,不能说明HNO2是弱酸,错误;D项若HNO2是强酸,其pH为1,由此说明HNO2是弱酸,属于弱电解质。
本题难度:一般