时间:2017-08-10 02:44:45
1、选择题 C、CO、CH4、C2H5OH是常用的燃料,他们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、283.0 kJ、890.3 kJ、1366.8 kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是:( )
A.C B. CO C. CH4 D. C2H5OH
参考答案:C
本题解析:设4种燃料的质量为m,则n(C)=" m/12" mol,n(CO)=" m/28" mol ,n(CH4)=" m/16" mol ,n(C2H5OH)=" m/46" mol,完全燃烧时放出热量:C为m/12×393.5kJ="32.8m" kJ,CO为m/28×283.0 kJ="10.1m" kJ
CH4为m/16×890.3 kJ="55.6m" kJ,C2H5OH为m/46×1366.8 kJ="29.7m" kJ,故C正确。
考点:反应热的简单计算。
本题难度:一般
2、选择题 下列事实与氢键有关的是(?)
A.水结成冰体积膨胀,密度变小
B.水加热到很高的温度都难以分解
C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
参考答案:A
本题解析:A.由于氢键的存在,使水结成冰时在固体中分子之间排列规则,使分子之间的距离增大,所以体积膨胀,密度变小。正确。B.水加热到很高的温度都难以分解这是由于在水分子中的化学键强,断裂难,与分子间的氢键的大小无关。错误。C.C、Si、Ge、Sn是同一主族的元素,它们形成的化合物CH4、SiH4、GeH4、SnH4结构相似。对于结构相似的物质来说,相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化或气化消耗的能量就越高。即物质的熔点、沸点随相对分子质量的增大而升高。正确。D.F、Cl、Br、I是同一主族的元素,由于从上到下,元素的非金属性逐渐减弱,元素的非金属性越弱,其形成的化合物的化学键结合力就越小,对于的氢化物HF、HCl、HBr、HI的热稳定性也依次减弱。但是这与氢键的形成与否无关。错误。
本题难度:一般
3、选择题 已知(l)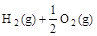 =H2O(g) ΔH1=a kJ·
=H2O(g) ΔH1=a kJ·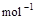
(2)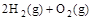 =2H2O(g) ΔH2=b kJ·
=2H2O(g) ΔH2=b kJ·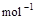
(3)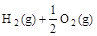 =H2O(l) ΔH3=c kJ·
=H2O(l) ΔH3=c kJ·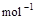
(4)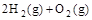 =2H2O(l) ΔH4=d kJ·
=2H2O(l) ΔH4=d kJ·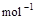
下列关系式中正确的是
A. a<c <0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:氢气与氧气反应生成水是放热反应,所以ΔH的值是小于0的,故BD错误,H2O(l)变成H2O(g)需要吸收能量,即a大于c,所以A错误,答案为C。
考点:反应热的比较
点评:本题考查了反应热的比较,注意要理解ΔH的意义,才能选择出正确的选项。
本题难度:简单
4、选择题 下列各组物质中化学键的类型相同的是( )
A.HCl?MgCl2?NH4Cl
B.H2O?Na2O?CO2
C.CaCl2?NaOH?H2O
D.NH3?H2O?CO2
参考答案:A.HCl中为共价键,MgCl2中为离子键,NH4Cl中既有离子键和共价键,故A不选;
B.H2O中为共价键,Na2O中为离子键,CO2中含共价键,故B不选;
C.CaCl2中为离子键,NaOH中既有离子键和共价键,H2O中为共价键,故C错误;
D.NH3中为共价键,H2O中为共价键,CO2中含共价键,故D选;
故选D.
本题解析:
本题难度:一般
5、选择题 以下说法正确的是()
A.某吸热反应能自发进行,因此该反应是熵增反应
B.常温下Na与足量O2反应生成Na2O随温度升高生成Na2O的速率逐渐加快
C.放热反应速率总是大于吸热反应速率
D.1gH2完全燃烧生成水蒸气时放出热量为121kJ,完全断裂1mol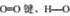 键吸收热量为496kJ、463kJ,则断裂1mol H-H键时吸收热量为902kJ
键吸收热量为496kJ、463kJ,则断裂1mol H-H键时吸收热量为902kJ
参考答案:A
本题解析:A. 某吸热反应能自发进行,根据体系的自由能ΔG=ΔH-TΔS<0,可以自发进行可知:该反应是熵增反应,正确;B. 常温下Na与足量O2反应生成Na2O,当温度升高后不仅该反应速率会增加,还会发生反应产生Na2O2,错误;C. 影响化学反应速率的大小的因素有很多,当可逆反应达到平衡时放热反应速率等于吸热反应速率,错误;D. 反应热是断键吸热与成键放热的差值。1gH2完全燃烧生成水蒸气时放出热量为121kJ,若完全断裂1molO=O键、H—O键吸收热量为496kJ、463kJ,则断裂1mol H-H键时吸收热量为[-121kJ×4+(4×463kJ )-496kJ ]÷2=436kJ,错误。
考点:考查反应的自发性、键能与反应热的关系、反应原理与温度及反应的热效应与温度的关系的知识。
本题难度:一般