时间:2017-08-10 02:44:45
1、选择题 下列分子中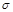 键与
键与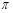 键数之比为3∶1的是(?)
键数之比为3∶1的是(?)
A.N2
B.C2H4
C.HCHO
D.HCN
参考答案:C
本题解析:单键全部是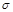 键,双键含有1个
键,双键含有1个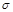 键和1个
键和1个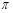 键,三键含有1个
键,三键含有1个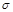 键和2个
键和2个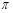 键。所以A~D中
键。所以A~D中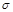 键与
键与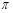 键数之比分别为1︰2、5︰1、3︰1、1︰1,因此正确的答案是C。
键数之比分别为1︰2、5︰1、3︰1、1︰1,因此正确的答案是C。
本题难度:一般
2、选择题 下表中评价不合理的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:A.碳酸镁不溶于水,在离子反应中保留化学式;
B.反应生成硫酸钡和氢氧化铜沉淀;
C.电荷不守恒;
D.电解氯化钠溶液生成NaOH、氯气、氢气.
解答:A.向碳酸镁中加入稀盐酸的离子反应为MgCO3+2H+=CO2↑+H2O+Mg2+,评价合理,故A不选;
B.向硫酸铜溶液中加入氢氧化钡溶液的离子反应为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,评价不合理,故B选;
C.向FeCl3溶液中加入Fe粉的离子反应为2Fe3++Fe=3Fe2+,评价合理,故C不选;
D.以石墨作电极电解氯化钠溶液的离子反应为2Cl-+2H2O 2OH-+H2↑+Cl2↑,评价合理,故D不选;
2OH-+H2↑+Cl2↑,评价合理,故D不选;
故选B.
点评:本题考查离子反应方程式的书写,明确发生的化学反应及离子反应方程式的书写方法即可解答,题目难度不大.
本题难度:困难
3、选择题 参照反应Br + H2 HBr +H的能量对反应历程的示意图(如右图),下列叙述中正确的
HBr +H的能量对反应历程的示意图(如右图),下列叙述中正确的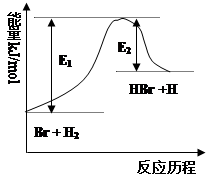
A.正反应为放热反应
B.正反应为吸热反应
C.加入催化剂,活化能改变引起反应热也改变
D.加入催化剂,正反应速率增大、逆反应速率减小
参考答案:B
本题解析:A、根据图像可知反应物的总能量低于生成物的总能量,因此反应是吸热反应,A错误;B、根据图像可知反应物的总能量低于生成物的总能量,因此反应是吸热反应,B正确;C、催化剂能改变活化能,但不能改变反应热,C错误;D、催化剂能同等程度改变正逆反应速率,D错误,答案选B。
考点:考查反应热、外界条件对反应热和反应速率的影响
本题难度:一般
4、选择题
A.氯化铵
B.金刚石
C.冰醋酸
D.硫酸钠
参考答案:C
本题解析:冰醋酸在熔化时,只是克服分子间作用力,晶体结构没有被破坏。
本题难度:一般
5、选择题 下列说法正确的是
A.在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ·mol-1
B.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C.在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.31 kJ·mol-1。若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
参考答案:B
本题解析:A中没有指明温度,错误;测定中和热是需要测量盐酸起始温度,NaOH起始温度和反应后终止温度,B对;燃烧热是指在25℃,101 kPa时,1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,1 mol C与适量O2反应生成1 mol CO时,没有完全燃烧,故放出的热量不是燃烧热,C错;浓硫酸溶解时要放出热量,故0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ,D错。
考点:燃烧热、中和热的定义的理解。
本题难度:一般