时间:2017-08-10 02:37:20
1、选择题 下列元素的原子在形成不同物质时,既能形成离子键,又能形成极性键和非极性键的是
[? ]
A.K
B.Ca
C.I
D.Ne
参考答案:C
本题解析:
本题难度:简单
2、选择题 固体乙醇中不存在的作用力是
[? ]
A.离子键
B.极性键
C.非极性键
D.氢键
参考答案:A
本题解析:
本题难度:简单
3、填空题 (1)请用下列10种物质的序号填空:①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2,只含有极性键的是__________,既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:________;若XY2为共价化合物时,其结构式为:_________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华。据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是__________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题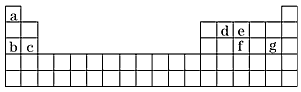
①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是________; A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式_______。
参考答案:(1)⑥⑦⑨;④;③⑤ (2)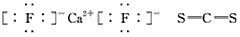 (3)共价化合物;氯化铝在熔融状态下不能导
(3)共价化合物;氯化铝在熔融状态下不能导
(4)①B;C;②CCl4(或PCl3)
本题解析:
本题难度:一般
4、选择题 中国科学院兰州近代物理研究所曾研制出首批重氧气(18O2),其价格远远超过黄金。下面对由18O构成的过重氧化氢(1H218O2)的叙述中正确的是(用NA表示阿伏加德罗常数)(?)
A.22.4L过重氧化氢所含的分子数为NA
B.过重氧化氢与过氧化氢的化学性质相似,都既有氧化性又有还原性,还具有酸性
C.过重氧化氢的摩尔质量为38g
D.过重氧化氢分子是由极性键形成的非极性分子
参考答案:B
本题解析:
正确答案:B
A、不正确,过重氧化氢为液体;
C.不正确,过重氧化氢的摩尔质量为38g/mol
D.不正确,过重氧化氢分子是由极性键形成的极性分子
本题难度:一般
5、填空题 A、B、C、D、E、F六种元素的原子序数依次增大。A的最高正价和最低负价的绝对值相等。B的基态原子有3个不同的能级且各能级中电子数相等。D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原了价电子排布式为?。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为?。(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有?。
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示。B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为?,该晶体的化学式为?。若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,,则该晶体的密度表达式为?g·cm3。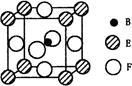
参考答案:(1)3d84s2
(2)Mg? C? O? N
(3)E
(4)孤电子对
(5)8? MgNi3C ?1030·M/﹝2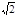 (r2+r3)3NA﹞
(r2+r3)3NA﹞
本题解析:根据题意可知这这几种元素分别是:A:H元素;B:C元素;C:N元素;D:O元素;E:Mg元素;F:Ni元素。(1)Ni的基态原了价电子排布式为3d84s2。(2)元素的非金属性越强,其越容易失去电子,电离能就越小。非金属性Mg < C < O < N ,所以它们的第一电离能由小到大的顺序为Mg < C < O < N。(3)在C2H2中 每个C原子采用sp杂化,与H原子形成1个σ键,与另一个C原子形成1个σ键和2个π键,而在H2O2中,每个O原子采用sp3杂化 ,与H原子核另一个O原子个形成一个σ键。在分子内无π键。所以A、B都错误。C.在C2H2中含有极性共价键C—H键和非极性共价键CC三键,但由于分子中各个化学键排列对称,所以属于非极性分子。而在H2O2中尽管也含有极性键H—O键和非碱性键O—O。但因为化学键排列不对称,所以该分子所以极性分子。错误。D. 原子数相等,电子数也相等的微粒称为等电子体。C2H2和H2O2的原子数相等,但是电子数不等,因此不能互为等电子体。错误。E. 结构相似的物质,相对分子质量越大,物质的熔沸点就越高。在相对分子质量相同或相差不多时,由极性分子构成的物质的分子间作用力大于非极性分子构成的物质的分子间作用力。所以极性分子构成的物质的熔、沸点大于非极性分子构成的物质的熔、沸点。因为C2H2和H2O2相对分子质量后者大,而且后者为碱性分子,所以H2O2比C2H2的沸点要高很多。正确。(4)早CO分子中含有孤对电子,所以容易与金属阳离子结合形成配位键。(5)根据晶胞结构示意图可知:在每个晶胞中含有C:1个;Mg:8×1/8=1个;Ni:6×1/2=3个。所以该晶体的化学式为:MgNi3C。1pm=10-10cm.设晶胞的边长为acm.则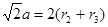 ,所以
,所以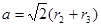 。
。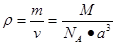 。整理可得ρ=1030·M/﹝2
。整理可得ρ=1030·M/﹝2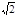 (r2+r3)3NA﹞
(r2+r3)3NA﹞
本题难度:一般