时间:2017-08-10 02:34:02
1、选择题 要除去FeCl2溶液中的少量氯化铁,可行的办法(?)
A.加入KSCN溶液
B.通入氯气
C.加入NaOH 溶液
D.加入铁粉
参考答案:D
本题解析:本题考查物质的分离提纯,结合主体物质及杂质的性质分析,除杂时遵循的原则为:除去杂质时不能增加新的杂质;不减少被提纯的物质;操作简单易行,易分离。A、加入KSCN溶液,铁离子与KSCN反应生成硫氰合铁离子,难以分离,错误;B、通入氯气,氯气与亚铁离子反应生成铁离子,减少了主体物质,错误;C、加入NaOH 溶液,亚铁离子与氢氧化钠反应生成氢氧化亚铁沉淀,减少了主体物质,错误;D、加入铁粉,铁离子能和铁反应生成亚铁离子,可用铁除去FeCl2溶液中的少量氯化铁,正确。
本题难度:一般
2、选择题 某同学进行下列实验:在加热条件下将24gCuO、Fe2O3的混合物与充足的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40g。下列有关叙述中不正确的是(?)
A.原混合物中CuO与Fe2O3物质的量比为1:1
B.反应后所得C O2的物质的量为0.4mol
O2的物质的量为0.4mol
C.实验过程中需要的CO 质量为11.2g
D.原混合物中CuO与Fe2O3的质量比为1:2
参考答案:C
本题解析:略
本题难度:一般
3、实验题 某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下:
Ⅰ. 配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉。
Ⅱ. 实验探究Fe3+与Fe2+相互转化
实验1:
0.1 mol/L FeCl2溶液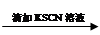 无明显现象
无明显现象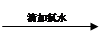 溶液变红
溶液变红
实验2:
0.1 mol/L FeCl3溶液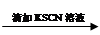 溶液变红
溶液变红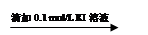 溶液红色未褪去
溶液红色未褪去
写出Fe(OH)2Cl与盐酸反应的离子方程式?。
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因?。
(3)实验2的现象与预测不同, 为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10 mL 0.1 mol/L KI溶液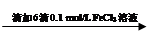 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2 mL黄色溶液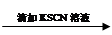 溶液变红
溶液变红
试管2 取3 mL黄色溶液 溶液变蓝
溶液变蓝
试管3 取3 mL黄色溶液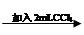 取上层溶液
取上层溶液 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
① 试管2中滴加K3[Fe(CN)6]检验的离子是?。
② 黄色溶液中含有的溶质微粒有K+、Cl-和?。
③ 综合上述实验现象,得出的实验结论是?。
参考答案:
(1)Fe(OH)2Cl + 2H+ = Fe3+ + Cl- + 2H2O(1分)
(2)2Fe2+ + Cl2 = 2Cl- + 2Fe3+(1分)
(3)①Fe2+(1分)?②Fe3+、Fe2+、I2?(2分)?③Fe3+与I-的反应为可逆反应(2分)
本题解析:
(1)根据题意可得:Fe(OH)2Cl + 2H+ = Fe3+ + Cl- + 2H2O
(2)Cl2 与Fe2+发生氧化还原反应:2Fe2+ + Cl2 = 2Cl- + 2Fe3+(1分)
(3)①K3[Fe(CN)6]专门用于检验的Fe2+试剂;?②滴加KSCN溶液溶液变红有Fe3+、加2滴K3[Fe(CN)6]溶液溶液变蓝有Fe2+、滴加6滴0.1 mol/L FeCl3溶液溶液明显变黄有I2?;③反应物、生成物都存在,试管3中实验说明平衡移动,则Fe3+与I-的反应必为可逆反应。
本题难度:一般
4、选择题 将适量铜粉放入FeCl3溶液中,完全反应后,溶液中的Fe3+和Cu2+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是………………(?)
A.2 :3
B.3 :2
C.1 :2
D.2 :1
参考答案:D
本题解析:略
本题难度:简单
5、选择题 把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。
最先观察到酚酞变红的现象的区域是
A.I和III
B.I和IV
C.II和III
D.II和IV
参考答案:B
本题解析:
正确答案:B
左边原电池,I作正极:2H2O+2e-=H2+2OH―,碱性增强;右边电解池, IV作阴极:2H2O+2e-=H2+2OH―,碱性增强
本题难度:简单