时间:2017-08-10 02:12:11
1、填空题 (14分)运用化学反应原理分析解答以下问题
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -41 kJ·mol-l
CO2(g)+H2(g) △H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
a.体系压强保持不变 B.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数 .
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2 = 2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式 .
参考答案:(每空2分,共14分)
(1)-247KJ·mol-1 K12·K2·K3
(2)a·c
(3) = K=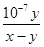 mol·L-1
mol·L-1
(4)碱性 O2+2H2O+4e-=4OH-
本题解析:(1)根据盖斯定律得3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
CH3OCH3(g) +CO2(g) △H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
(2)a、容器体积固定,3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)是反应前后气体压强发生改变的可逆反应,所以体系压强保持不变时达平衡状态,正确;b、容器体积固定,根据质量守恒定律,得气体的密度始终不变,所以不能作为平衡状态到达的标志,错误;c、反应开始时,CO和H2的物质的量一直减少,当CO和H2的物质的量保持不变,不再减少时证明已达平衡状态,正确;d、CO的消耗速率任何状态都不等于CO2的生成速率,错误,答案选ac;
CH3OCH3(g) +CO2(g)是反应前后气体压强发生改变的可逆反应,所以体系压强保持不变时达平衡状态,正确;b、容器体积固定,根据质量守恒定律,得气体的密度始终不变,所以不能作为平衡状态到达的标志,错误;c、反应开始时,CO和H2的物质的量一直减少,当CO和H2的物质的量保持不变,不再减少时证明已达平衡状态,正确;d、CO的消耗速率任何状态都不等于CO2的生成速率,错误,答案选ac;
(3)根据电荷守恒定律,盐酸与氨水混合后的溶液显中性,则c(H+)=c(OH-),c(Cl-)+ c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+);在25℃下,中性溶液中c(H+)= c(OH-)=1×10-7mol/L,若盐酸与氨水的浓度相等,则等体积混合后生成氯化铵溶液显酸性,而实际溶液显中性,说明氨水的浓度大于盐酸的浓度,氨水过量,设二者的体积均为1L,与盐酸反应完剩余氨水的物质的量(x-y)mol,一水合氨的浓度为(x-y)/2mol/L,c(NH4+)=c(Cl-)=y/2mol/L,则氨水的电离平衡常数K= c(OH-)c(NH4+)/ c(NH3·H2O)= 1×10-7mol/L×y/2mol/L/(x-y)/2mol/L=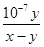 mol·L-1,
mol·L-1,
(4)根据电池反应式为:4NH3+3O2 =2N2+6H2O,判断氨气发生氧化反应,氧气发生还原反应,氨气失电子成为氮气和氢离子,所以电解质溶液应显碱性,产物中才能生成水;因为电解质溶液为碱性,所以正极是氧气的还原反应,氧气得电子与水结合生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-
考点:考查盖斯定律的应用 ,化学平衡状态的判断,化学平衡常数的计算,原电池反应原理的应用
本题难度:困难
2、实验题 (15分)50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算反应热。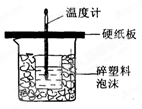
请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 ;(由图可知该装置有两处不妥之处:(1) 。(2 ) 。
(2)烧杯间填满碎塑料泡沫的作用是________。
(3)大烧杯上如不盖硬纸板,则求得的反应热数值___。(填“偏大”、“偏小’、“无影响”)。
(4)若实验过程中,测得盐酸和NaOH溶液的起始温度的平均值为25.2℃.溶液混合后的最高温度为28.6℃.试经过计算写出表示该反应中和热的热化学方程式:________
(混合溶液的比热容c=4.18J/(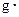 ℃),盐酸和NaOH溶液的密度认为都是1
℃),盐酸和NaOH溶液的密度认为都是1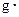
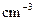 )
)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会____(填“偏大”、“偏小”、“无影响”)。
参考答案: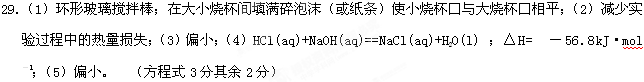
本题解析:略
本题难度:一般
3、选择题 氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1?mol氢气中的化学键消耗的能量为Q1kJ,破坏1?mol氯气中的化学键消耗的能量为Q2?kJ,形成1?mol氯化氢中的化学键释放的能量为Q3?kJ。下列关系式正确的是
[? ]
A.Q1+Q2>Q3?
B.Q1+Q2>?2Q3 ?
C.Q1+QE<Q3?
D.Q1+Q2<2Q3
参考答案:D
本题解析:
本题难度:一般
4、填空题 在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Al+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为?,含有离子键、?等化学键。
(2)生成物中含有10个电子的分子是?(写分子式),该分子的空间构型为?,中心原子的杂化方式为?。
(3)反应物中电负性最大的元素为?(填元素符号),写出其原子最外层的电子排布图:?。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。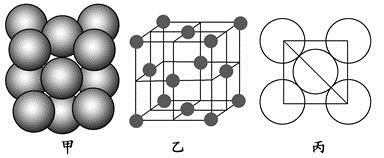
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为?;Al晶体的密度为?(用字母表示)。
参考答案:(1)Na3AlF6 配位键
(2)H2O V形 sp3
(3)F 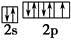
(4)4 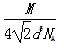
本题解析:(1)冰晶石的化学式为Na3AlF6,Na+与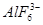 之间为离子键,而
之间为离子键,而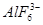 是以配位键形成的。(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子含有两对孤电子对,故分子结构为V形。(3)F是电负性最大的元素,其最外层电子排布图为
是以配位键形成的。(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子含有两对孤电子对,故分子结构为V形。(3)F是电负性最大的元素,其最外层电子排布图为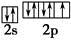 。(4)铝晶胞的原子处于晶胞顶角和面心,故一个晶胞含有的Al原子数目为6×
。(4)铝晶胞的原子处于晶胞顶角和面心,故一个晶胞含有的Al原子数目为6×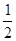 +8×
+8×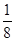 =4。设Al晶胞的边长为a,则有:2a2=(4d)2,a=2d,Al晶胞的体积为V=16d3,故Al晶体的密度为
=4。设Al晶胞的边长为a,则有:2a2=(4d)2,a=2d,Al晶胞的体积为V=16d3,故Al晶体的密度为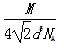 。
。
本题难度:一般
5、填空题 (3分)不同的物质不仅组成不同、结构不同 ,所包含的 也不同。放热反应的宏观表现是 ,其微观表现是 。
,所包含的 也不同。放热反应的宏观表现是 ,其微观表现是 。
参考答案:化学能;反应物总能量高于生成物总能量;断开化学键吸收的能量少于形成化学键放出的能量。 (每空1分,共3分)
本题解析:略
本题难度:一般