时间:2017-08-10 02:11:49
1、简答题 有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.
(1)A2B2的电子式为______.
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示).在b电极上发生的反应可表示为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为______.
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中(如图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为______.
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为______.比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是______.
参考答案:A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素.
(1)A2B2为H2O2,为共价化合物,电子式为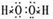
,故答案为: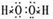
;
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池,负极反应为Pb-2e-+SO42-=PbSO4,
故答案为:Pb-2e-+SO42-=PbSO4;?
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,铁做负极,发生反应为Fe-2e-=Fe2+,在正极上得电子被还原,发生反应为2Fe3++2e-=2Fe2+,氧化反应和还原反应分别在不同极上发生.
故答案为:2Fe3++2e-=2Fe2+;使还原反应和氧化反应在电解质溶液中的不同区域内发生.
本题解析:
本题难度:一般
2、填空题 (6分)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应为_____________?_,若反应过程中转移了2mol电子,可产生水的质量为??g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,.其中c(Na+)=" 3" c(Cu2+ )=" 0.3" mol/L,取该混合液100 mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112 L(已折算到标准状况)气体。此时氢氧燃料电池外电路中转移电子的物质的量为?mol。(不考虑电路中的其它损耗)。
参考答案:(1)O2 + 4H+ + 4e- = 2H2O ;18 ;(2)0.03 ;(各2分)
本题解析:(1)在燃料电池中正极通入的是氧气,所以正极反应式为O2 + 4H+ + 4来源:91考试网 91ExaM.orge- = 2H2O。因为总反应是O2 + 2H2 = 2H2O,反应中转移的电子是4mol,所以若反应过程中转移了2mol电子,可产生水的质量为18g。
(2)在阴极上首先是铜离子放电,析出铜,然后是氢离子放电,生成氢气。铜离子是0.1mol/L×0.1L=0.01mol,得到的电子是0.02mol。氢气是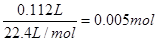 ,转移的电子是0.01mol,所以转移的总的电子是0.03mol。
,转移的电子是0.01mol,所以转移的总的电子是0.03mol。
本题难度:一般
3、选择题 下图各装置中,不能发生原电池反应的是
[? ]
A.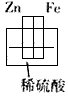
B.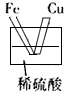
C.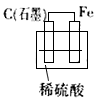
D.
参考答案:D
本题解析:
本题难度:简单
4、填空题 因“召回门”而闹得沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放 热569.1 kJ。则该反应的热化学方程式为___________________
(2)混合动力车的电动机目前一般使用的是镍氢电池, 镍氢电池采用镍的化合物为正极,储氢金属(以M 表示)为负极,碱液(主要为KOH)为电解液。
①镍氢电池充放电原理如图所示(图中MH为吸附了氢原子的储氢合金),其总反应式是____________________。 
②根据所给信息判断,混合动力车下坡或刹车时,甲电极的电极反应式为_________________;混合动力车上坡或加速时,乙电极的电极反应式为____________________
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:CO(g) +1/2O2(g) CO2(g)
CO2(g)
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所 示。请填写表中的空格。

参考答案:(1)C8H18(l) +25/2O2(g)= 8CO2(g) +9H2O(g) △H=-5121.9 kJ/mol
(2)①MH+NiOOH M+Ni(OH)2;②M+H2O+e-=MH+OH-;NiOOH+H2O+e-= Ni(OH)2+OH-
M+Ni(OH)2;②M+H2O+e-=MH+OH-;NiOOH+H2O+e-= Ni(OH)2+OH-
(3)①v(正)<v(逆);②1.1×10-6
本题解析:
本题难度:一般
5、选择题 用两根铂丝做电极插入KOH溶液中,再向两个电极上分别通甲烷气和氧气可形成原电池——燃料电池,根据两极反应的实质判断,
的一极,在下列叙述中正确的是
A.阴极:4H2O+2O2+8e=8OH-
B.正极:4H2O+2O2+8e=8OH-
C.阴极:4OH--4e=2H2O+O2↑
D.正极:4OH--4e=2H2O+O2↑
参考答案:B
本题解析:从CH4一极所发生的失电子电极反应式看,通CH4的一极应为原电池的负极,通氧的一极必为原电池的正极,正极应发生得电子的还原反应,且两极得失电子的数目相等,从题给选项看,应选B。
本题难度:一般