?
2、选择题 提纯含有少量Ba(NO3)2杂质的KNO3溶液,可使用的方法为
A.加入过量Na2CO3溶液,过滤,除去沉淀,溶液中补加适量HNO3
B.加入过量K2SO4溶液,过滤,除去沉淀,溶液中补加适量HNO3
C.加入过量Na2SO4溶液,过滤,除去沉淀,溶液中补加适量HNO3
D.加入过量K2CO3溶液,过滤,除去沉淀,溶液中补加适量HNO3
3、实验题 碳酸钠—过氧化氢加合物(aNa2CO3·bH2O2)具有漂白、杀菌作用。实验室用“醇析法”制备该物质的实验步骤如下:
第1步:取适量碳酸钠溶解于一定量水里,倒入烧瓶中;再加入少量稳定剂(MgCl2和Na2SiO3),搅拌均匀。
第2步:将适量30%的H2O2溶液在搅拌状态下滴入烧瓶中,于15 ℃左右反应1 h。
第3步:反应完毕后再加入适量无水乙醇,静置、结晶,过滤、干燥得产品。
(1)第1步中,稳定剂与水反应生成两种常见的难溶物,其化学方程式为___________________________________________________________。
(2)第2步中,反应保持为15 ℃左右可采取的措施是_____________________
___________________________________________________。
(3)第3步中,无水乙醇的作用是____________________________________。
(4)H2O2的含量可衡量产品的优劣。现称取m g(约0.5 g)样品,用新煮沸过的蒸馏水配制成250 mL溶液,取25.0 mL于锥形瓶中,先用稀硫酸酸化,再用c mol·L-1 KMnO4溶液滴定至终点。
①配制250 mL溶液所需的玻璃仪器有烧杯、玻璃棒、量筒________、________;
②滴定终点观察到的现象是______________________________________。
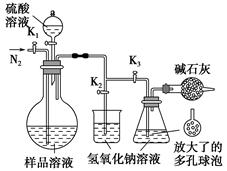
(5)可模拟用蒸馏法测定样品中碳酸钠的含量。装置如右图所示(加热和固定装置已略去),实验步骤如下:
步骤1:按右图所示组装仪器,检查装置气密性。
步骤2:准确量取(4)中所配溶液50 mL于烧瓶中。
步骤3:准确量取40.00 mL约0.2 mol·L-1 NaOH溶液两份,分别注入烧杯和锥形瓶中。
步骤4:打开活塞K1、K2,关闭活塞K3缓缓通入氮气一段时间后,关闭K1、K2,打开K3;经分液漏斗向烧瓶中加入10 mL 3 mol·L-1硫酸溶液。
步骤5:加热至烧瓶中的液体沸腾,蒸馏,并保持一段时间。
步骤6:经K1再缓缓通入氮气一段时间。
步骤7:向锥形瓶中加入酸碱指示剂,用c1 mol·L-1 H2SO4标准溶液滴定至终点,消耗H2SO4标准溶液V1 mL。
步骤8:将实验步骤1~7重复两次。
①步骤3中,准确移取40.00 mL NaOH溶液所需要使用的仪器是________;
②步骤1~7中,确保生成的二氧化碳被氢氧化钠溶液完全吸收的实验步骤是________(填序号);
③为获得样品中碳酸钠的含量,还需补充的实验是______________________。
4、选择题 1molN2和44gCO2的气体体积,前者和后者的关系是
A.大于
B.等于
C.小于
D.不能确定
5、选择题 从海水中可以提取溴,但得到的液溴中常常溶有少量氯气, 除去氯气应该采用的方法是
[? ]
A.加适量的KI溶液
B.通入溴蒸气
C.加入适量的NaOH溶液
D.加入适量的NaBr溶液
|