时间:2017-08-10 01:46:51
1、选择题 乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH CH3COOC2H5+H2O.若用如图所示的装置来制备少量的乙酸乙酯,下列因素:①乙醇挥发;②浓硫酸催化效果较差;③反应温度过高生成乙醚,能导致产率偏低的是( ? )
CH3COOC2H5+H2O.若用如图所示的装置来制备少量的乙酸乙酯,下列因素:①乙醇挥发;②浓硫酸催化效果较差;③反应温度过高生成乙醚,能导致产率偏低的是( ? )
A.只有①
B.只有①②
C.只有①③
D.①②③都可以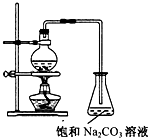
参考答案:C
本题解析:
本题难度:一般
2、实验题 实验室合成SO3的装置如图,试回答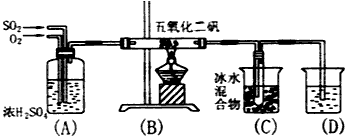
(1)装置(A)的作用:1______________2_______________3_______________
(2)从(B)处导出的气体成分(写出化学式)_________________
(3)(C)的冰水混合物的作用是_________________
参考答案:(1)干燥;控制气流速度;使气体充分混合
(2)SO3和SO2
(3)使SO3使冷却成为固体
本题解析:
本题难度:一般
3、实验题 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: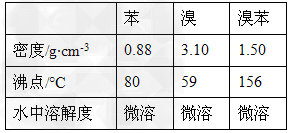
按下列合成步骤回答问题 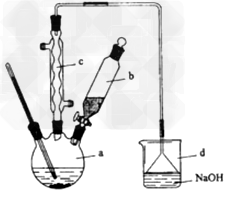
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了______气体。继续滴加至液溴滴完。装置d的作用是_____________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是_____
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为___,要进一步提纯,下列操作中必须的是____(填入正确选项前的字母);
A.重结晶?B.过滤?C.蒸馏?D.萃取
(4)在该实验中,a的容积最适合的是___(填入正确选项前的字母)。
A.25mL?B.50mL?C.250mL?D.500mL
参考答案:(1)HBr;?吸收HBr和Br2
(2)②除去HBr和未反应的Br2;③干燥
(3)苯;C
(4)B
本题解析:
本题难度:一般
4、填空题 下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓H2SO4混合共热的方法制取乙酸乙酯,反应的方程式为______
其中浓H2SO4的作用是______和______
[装置设计]甲、乙、丙三位同学分别设计下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是______(选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是______
[实验步骤]
①按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓H2SO4?充分摇匀,冷却后再加入2mL冰醋酸;②将试管固定在铁架台上;③在试管B中加入适量的饱和Na2CO3溶液;④用酒精灯对试管A加热;⑤当观察到试管B中有明显现象时停止实验.
[问题讨论]
(1)步骤①装好实验装置,加入样品前还应检查______
(2)试管B中饱和Na2CO3溶液的作用是______
(3)从试管B中分离出乙酸乙酯的实验操作是______.
参考答案:[实验原理]乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,CH3COOH+C2H5OH 浓H2SO4
本题解析:
本题难度:一般
5、实验题 锂离子电池的广泛应用使回收利用锂货源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下
(1)第②步反应得到的沉淀X的化学式为_____________。
(2)第③步反应的离子方程式是______________。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有_________?。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因________、__________。
参考答案:(1)Al(OH)3
(2)4LiMn2O4+O2+4H+=4Li++8MnO2+2H2O
(3)漏斗、玻璃棒 烧杯;滤纸破损;滤液超过滤纸边缘(答案合理即可)
本题解析:
本题难度:一般