时间:2017-08-10 01:36:22
1、选择题 氢氟酸(HF)是一种弱酸。25℃时,向20mL0.1mol/L氢氟酸中加入VmL 0.1mol/LNaOH溶液充分反应。已知:
HF(aq)+OH-(aq)=F-(aq)+H2O(l) △H=-67.7kJ/mol
H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol
根据题意,下列判断或结论正确的是
A.氢氟酸的电离过程是吸热的
B.当V=20时,溶液中:c(F-)<c(Na+)=0.1mol/L
C.当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-)
D.当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+)
参考答案:C
本题解析:A、根据盖斯定律,将上式相减可得氢氟酸的电离方程式,反应热为-67.7kJ/mol-(-57.3kJ/mol)=-10.4kJ/mol<0,所以氢氟酸的电离过程是放热的,错误;B、当V=20时,氢氟酸与氢氧化钠溶液恰好完全反应生成NaF,溶液体积为40mL,因为氢氟酸是弱酸,所以氟离子会发生水解,使溶液成碱性,则c(F-)<c(Na+)=0.05mol/L,错误;C、因为恰好完全反应时溶液呈碱性,则当V<20时,溶液可能呈中性,溶液中离子浓度关系可能为:c(Na+)=c(F-)> c(OH-)= c(H+),正确;D、当V>20时,溶液为NaF和NaOH的混合液,溶液中的离子浓度可能是c(Na+)>c(F-)>c(OH-)>c(H+),也可能是c(Na+)>c(OH-)>c(F-)>c(H+),错误,答案选C。
考点:考查盖斯定律的应用,溶液中离子浓度大小关系的判断
本题难度:困难
2、填空题 (11分) (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示。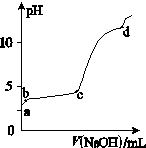
(1)写出a点溶液呈酸性的离子方程式:
(2)若c点时V(NaOH)为90ml,则Al2(SO4)3溶液的物质的量浓度约为:
(3)写出b~c段反应的离子方程式: ,
(4)d点时,V(NaOH)约为
(Ⅱ)常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(2)若将③和④的溶液混合后溶液恰好呈中性则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
参考答案: (Ⅰ) (1) Al3++3H2O  Al(OH)3+3OH-; (2) 0.5 mol/L(2分);
Al(OH)3+3OH-; (2) 0.5 mol/L(2分);
(3) Al3++3OH- = Al(OH)3↓(2分);(4)120(2分);
(Ⅱ) (1)增大(2)小于,c(Cl-)=c(NH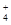 )>c(OH-)=c(H+)(2分)
)>c(OH-)=c(H+)(2分)
本题解析:(Ⅰ)(1)Al2(SO4)3是强酸弱碱盐,在溶液中Al3+会发生水解反应消耗水电离产生的OH-,使溶液中c(H+)>c(OH-),所以最终使溶液显酸性,离子方程式是:Al3++3H2O  Al(OH)3+3OH-;(2)若c点时V(NaOH)为90ml,溶液的pH="5," Al2(SO4)3溶液的pH增大一倍,在加入NaOH,溶液 pH会发生大的变化,说明Al2(SO4)3恰好反应完全。根据反应方程式:Al3++3OH- = Al(OH)3↓,n(OH-)=0.09L×1.0mol/L=0.09mol,则n(Al3+)=0.03mol,n(Al2(SO4)3)=0.015mol,则Al2(SO4)3溶液的物质的量浓度约为:0.015mol÷0.03L=0.5 mol/L; (3)在b~c段反应的离子方程式是Al3++3OH- = Al(OH)3↓;(4) 在d点时,产生的Al(OH)3恰好被完全溶解,根据反应方程式Al(OH)3+ OH-= AlO2-+ 2H2O可知:n(Al(OH)3)=n(Al3+)=0.03mol又消耗NaOH的物质的量是0.03mol,其体积是0.03mol÷ 1mol/L=" 0.03L=" 30ml,所以V(NaOH)约为90ml+30ml=120ml;(Ⅱ) (1) 在氨水中存在电离平衡:NH3·H2O
Al(OH)3+3OH-;(2)若c点时V(NaOH)为90ml,溶液的pH="5," Al2(SO4)3溶液的pH增大一倍,在加入NaOH,溶液 pH会发生大的变化,说明Al2(SO4)3恰好反应完全。根据反应方程式:Al3++3OH- = Al(OH)3↓,n(OH-)=0.09L×1.0mol/L=0.09mol,则n(Al3+)=0.03mol,n(Al2(SO4)3)=0.015mol,则Al2(SO4)3溶液的物质的量浓度约为:0.015mol÷0.03L=0.5 mol/L; (3)在b~c段反应的离子方程式是Al3++3OH- = Al(OH)3↓;(4) 在d点时,产生的Al(OH)3恰好被完全溶解,根据反应方程式Al(OH)3+ OH-= AlO2-+ 2H2O可知:n(Al(OH)3)=n(Al3+)=0.03mol又消耗NaOH的物质的量是0.03mol,其体积是0.03mol÷ 1mol/L=" 0.03L=" 30ml,所以V(NaOH)约为90ml+30ml=120ml;(Ⅱ) (1) 在氨水中存在电离平衡:NH3·H2O NH4++OH-,若向其中中加入少量氯化铵固体,由于c(NH4+)增大,平衡逆向移动,c(OH-)减小,但是平衡移动的趋势是微弱的,总的来说,c(NH4+)增大,所以此时c(NH4+)/c(OH-)的值增大;(2)盐酸是强酸,完全电离,一水合氨是弱碱,部分电离,原来二者的浓度相等,所以若将③HCl和④氨水的溶液等体积混合,则二者恰好反应,醋酸的盐是强酸弱碱盐盐,水解使溶液显酸性,而为了使混合后溶液恰好呈中性,则混合前③的体积要略小于④的体积。盐电离产生的两种浓度远大于水的电离产生的离子浓度,所以根据电荷守恒及溶液显中性可知此时溶液中离子浓度由大到小的顺序是c(Cl-)=c(NH
NH4++OH-,若向其中中加入少量氯化铵固体,由于c(NH4+)增大,平衡逆向移动,c(OH-)减小,但是平衡移动的趋势是微弱的,总的来说,c(NH4+)增大,所以此时c(NH4+)/c(OH-)的值增大;(2)盐酸是强酸,完全电离,一水合氨是弱碱,部分电离,原来二者的浓度相等,所以若将③HCl和④氨水的溶液等体积混合,则二者恰好反应,醋酸的盐是强酸弱碱盐盐,水解使溶液显酸性,而为了使混合后溶液恰好呈中性,则混合前③的体积要略小于④的体积。盐电离产生的两种浓度远大于水的电离产生的离子浓度,所以根据电荷守恒及溶液显中性可知此时溶液中离子浓度由大到小的顺序是c(Cl-)=c(NH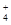 )>c(OH-)=c(H+)。
)>c(OH-)=c(H+)。
考点:考查盐的水解平衡及影响因素、盐与碱反应时的物质的量的关系、溶液中离子浓度的大小关系的比较的知识。
本题难度:一般
3、选择题 Na2CO3水溶液中存在CO2-3+H2O HCO-3+OH-平衡。下列说法不正确的是
HCO-3+OH-平衡。下列说法不正确的是
A.稀释溶液,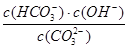 增大
增大
B.通入CO2,溶液pH减小
C.升高温度,此平衡常数增大
D.加入NaOH固体, 减小
减小
参考答案:A
本题解析:A、稀释溶液,水解平衡向左移动,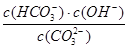 减小,A错误;B、通入CO2,由于H2CO3
减小,A错误;B、通入CO2,由于H2CO3 HCO-3+H+,溶液pH减小,B正确;C、水解是吸热过程,升高温度,此平衡常数增大,C正确;D、加入NaOH固体,CO2-3+H2O
HCO-3+H+,溶液pH减小,B正确;C、水解是吸热过程,升高温度,此平衡常数增大,C正确;D、加入NaOH固体,CO2-3+H2O HCO-3+OH-平衡向左移动,
HCO-3+OH-平衡向左移动, 减小,D正确;答案选A。
减小,D正确;答案选A。
考点:盐的水解平衡
本题难度:一般
4、选择题 相同状况下,等体积的下列溶液,阴离子的总浓度最大的是
A.0.2 mol/LK2S
B.0.1 mol/LBa(OH)2
C.0.2 mol/LNaCl
D.0.2 ml/L(NH4)2SO4
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl)
B.已知25°C时 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1
mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
参考答案:C
本题解析:C错;设溶液的体积各为1L;即0.2mol·L-1 HCl溶液中 ;0.05 mol·L-1 Ba(OH)2溶液中
;0.05 mol·L-1 Ba(OH)2溶液中 ;混合后,溶液中
;混合后,溶液中 ,混合后溶液中
,混合后溶液中 ,此时溶液的pH=1.3
,此时溶液的pH=1.3
本题难度:困难