时间:2017-08-10 01:36:01
1、填空题 I.目前,我国采用“接触法”制硫酸,设备如图所示: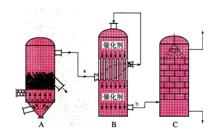
(1)图中设备A的名称是_____________?该设备中主要反应的化学方程式为?。
(2)有关接触法制硫酸的下列说法中,不正确的是______________。
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为?。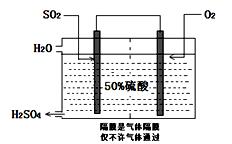
II. 纯碱是一种重要的化工原料。目前制碱工业主要有 “氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:?;
(2)写出“联合制碱法”有关反应的化学方程式:?;
?。
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于?,
“ 氨碱法”中CO2来源于?;
氨碱法”中CO2来源于?;
2、填空题 (14分)青铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)?冶炼铜的反应为
8CuFeS2 + 21O2 8Cu + 4FeO + 2Fe2O3 + 16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是_________(填元素符号)。
(2)?上述冶炼过程产生大量SO2,下列处理方案中合理的是__________(填代号)。
a.?高空排放? b.用于制备硫酸
c.?用纯碱溶液吸收制Na2SO4? d.用浓硫酸吸收
(3)?过二硫酸钾(K2S2O8)具有强氧化性,可将I?氧化为I2:S2O82? + 2I? → 2SO42? + I2;通过改变反应途径,Fe3+、Fe2+均可催化上述反应,试用离子方程式表示Fe3+对上述反应催化的过程:__________、__________。
(4)?利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.?除去Al3+ 的离子方程式是____________________________;
b.?选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸?稀硫酸? KSCN溶液? KMnO4溶液? NaOH溶液?碘水
所选试剂为__________,证明炉渣中含有FeO的实验现象为____________________。
3、选择题 认识反应条件对化学反应的影响,对学好化工生产知识具有重要意义。下列说法不正确的是? ( )。
A.SO2合成SO3虽然属于放热反应,但工业上合成SO3时仍需加热
B.合成氨工业采用高温高压和使用催化剂,因这些条件都符合化学平衡原理
C.合成纯碱的过程中,应首先向饱和食盐水中通入NH3,再通入足量CO2
D.通过加压降温的方法可获得制备NH3的原料气N2
4、填空题 (1)下列关于工业生产说法正确的是?。(填序号)
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+?、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | < 0.004 5 mol·L-1? | <100个·mL-1? |

5、选择题 绿色:环境保护也是我们的生活理念。下列实验符合“绿色环保”思想的是
[? ]
A.氯气溶于水制氯水 
B.铜与浓硫酸反应 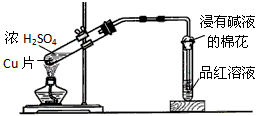
C.实验室制备并收集氯化氢气体 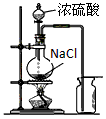
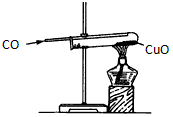
D.一氧化碳还原氧化铜