时间:2017-08-10 01:03:22
1、选择题 有关理论认为N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,下列说法合理的是
A.N2O与SiO2为等电子体、具有相似的结构(包括电子式)
B.N2O的电子式可表示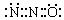
C.N2O与CO2均不含非极性键
D.N2O为三角形分子
参考答案:B
本题解析:A选项,二氧化硅是原子晶体,笑气是分子晶体,二氧化硅中电子数是30,笑气中电子数是22,所以笑气和SiO2不是等电子体,其结构不同,故A错误;B选项,二氧化碳的电子式为: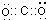 ,二氧化碳和笑气分子具有相似的结构(包括电子式),且N2O分子中氧原子只与一个氮原子相连,所以笑气的电子式为:
,二氧化碳和笑气分子具有相似的结构(包括电子式),且N2O分子中氧原子只与一个氮原子相连,所以笑气的电子式为: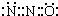 ,故B正确;C选项笑气的电子式为:
,故B正确;C选项笑气的电子式为: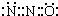 ,笑气中存在氮氮键,所以含有非极性键,故C错误;D选项N2O与CO2分子具有相似的结构,二氧化碳是直线型分子,所以笑气是直线型分子,故D错误
,笑气中存在氮氮键,所以含有非极性键,故C错误;D选项N2O与CO2分子具有相似的结构,二氧化碳是直线型分子,所以笑气是直线型分子,故D错误
本题难度:一般
2、选择题 根据相关化学原理,下列判断正确的是( )
A.若X和Y是同主族元素,且Y位于X的下方,则其单质的熔点:X<Y
B.NaHCO3溶液中,c(H+)<c(CO32-)
C.若R2+和M+的电子层结构相同,则原子序数:R<M,离子半径:R2+<M+
D.若非金属性:X>Y,则其氢化物的稳定性:HX>HY
参考答案:A、若X和Y是同主族元素,且Y位于X的下方,若为典型非金属族,如卤族,自上而下单质熔点增大,则熔点:X<Y,若为典型金属,如碱金属,自上而下单质熔点增大,则熔点:X>Y,故A错误;
B、NaHCO3溶液中,氢离子来源于水的电离与碳酸氢根的电离,碳酸氢根电离的氢离子与碳酸根离子相等,水还电离出氢离子,所以NaHCO3溶液中c(H+)>c(CO32-),故B错误;
C、R2+和M+的电子层结构相同,则核外电子数相同,由于阳离子电子数=质子数-所带电荷守恒,所以质子数R>M,即原子序数R>M,核外电子排布相同,核电荷数越大,所以离子半径R2+<M+,故C错误;
D、非金属性越强,氢化物越稳定,金属性:X>Y,则其氢化物的稳定性:HX>HY,故D正确.
故选D.
本题解析:
本题难度:一般
3、填空题 A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C?元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2型共价化合物和C2A型离子化合物.由上述条件回答下列问题:
(1)A、B、C三元素的名称分别是:A______,B______,C______.
(2)化合物C2A的电子式是______.
(3)化合物BA2的电子式是:______,结构式是:______.
参考答案:A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子,则M层电子数为8-2=6,故A为硫元素;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等,B处于第二周期,最外层电子数为4,则B为碳元素;C?元素的阳离子核外电子排布与Ne原子核外电子排布相同,C处于第三周期,形成C2A型离子化合物,C为+1价离子,故C为Na元素,
(1)由上述分析可知,A为硫,B为碳,C为钠,故答案为:硫;碳;钠;
(2)Na2S由钠离子与硫离子构成,电子式为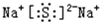
,故答案为: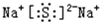
;
(3)CS2分子中碳原子与硫原子之间形成2对共用电子对,电子式为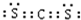
,结构式为S=C=S,故答案为: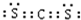
;S=C=S.
本题解析:
本题难度:一般
4、选择题 下列化学式能真实表示物质分子组成的是(?)
A.NaOH
B.SO2
C.P(白磷)
D.SiO2
参考答案:B
本题解析:只有分子晶体才存在分子,所以选项B正确;A是离子晶体,D是原子晶体,均表示化学式;白磷的分子式为P4,C不正确,答案选B。
本题难度:一般
5、选择题 已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是 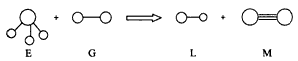
[? ]
A.G是最活泼的非金属单质
B.M化学性质活泼
C.E能使紫色石蕊试液变蓝色
D.L是极性分子
参考答案:B
本题解析:
本题难度:一般