时间:2017-08-10 01:02:16
1、选择题 在下列分子结构中,有原子的最外层电子不能满足8电子稳定结构的是?(? )
A.N2
B.PCl3
C.XeF2
D.CO2
2、选择题 下列说法正确的是( )
A.非金属原子间以共价键结合的物质都是共价化合物
B.1mol氢氧化钡与足量盐酸发生中和反应生成水时所释放的热量称为中和热
C.原电池工作时电流从正极流向负极
D.凡是能电离出离子的化合物都是离子化合物
3、选择题 下列说法正确的是( )
①水银不是银②干冰不是冰③铅笔不含铅④金刚石不含金.
A.①④
B.②
C.②③
D.①②③④
4、填空题 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。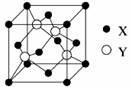
①在1个晶胞中,X离子的数目为?。
②该化合物的化学式为?。若其晶胞边长为540.0pm,则密度为?,X与最近的Y之间的距离为?
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是?。
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为?(用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:?。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为?。
5、填空题 【物质结构与性质】
M是原子序数<30的一种金属,常用于航空、宇航、电器及仪表等工业部门,M原子的最外层有空轨道,且有两个能级处于电子半充满状态。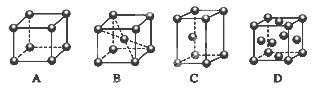
(1)M原子的外围电子排布式为__________,在周期表中属于?区元素。
(2)M的堆积方式属于钾型,其晶胞示意图为______(填序号)。
(3)MCl3·6H2O有三种不同颜色的异构体
A、[M(H2O)6]Cl3?B、[M(H2O)5Cl]Cl2·H2O和C、[M(H2O)4Cl2]Cl·2H2O。为测定蒸发MCl3溶液析出的暗绿色晶体是哪种异构体,取0.010 mol MCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870 g。该异构体为?(填A或B或C)。
(4)MO2Cl2常温下为暗红色液体,熔点-96.5℃,沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态MO2Cl2属于________晶体;
②CS2中碳原子和丙酮(CH3COCH3)羰基中的碳原子分别采取的杂化方式为____杂化和________杂化。
(5)+3价M的配合物K[M(C2O4)2(H2O)2]中,配体是______,与C2O42-互为等电子体的分子是(填化学式)__________。