时间:2017-08-10 00:50:59
1、选择题 下列有关实验操作正确的是
参考答案:B
本题解析:A、氢氧化钠也吸收氯气,应该用饱和食盐水,A不正确;B、实验室制备氨气利用熟石灰与氯化铵混合加热,采用向上排空气法收集,B正确;C、酒精与水互溶,不能用作萃取碘水中的碘,可以用四氯化碳或苯,C不正确;D、托盘天平称量氢氧化钠固体是应该用小烧杯,且是左物右码,D不正确,答案选B。
本题难度:简单
2、选择题 下列基本实验操作正确的是(? )?
A 稀释浓硫酸时将水沿器壁缓慢注入浓硫酸中,同时不断搅拌,防止酸液溅出
B 过滤时,滤纸的边缘要高于漏斗的边缘,防止液体从滤纸和漏斗壁之间流下
C 胶头滴管的尖嘴部分直接伸入试管里滴加液体,避免液体溅出到试管口上
D 实验室取用液体药品做性质实验时,如果没有说明用量,一般取1~2ml
参考答案:D
本题解析:A错,稀释浓硫酸时将浓硫酸沿器壁缓慢注入水中,同时不断搅拌,防止酸液溅出;B错,过滤时,滤纸的边缘要低于漏斗的边缘,防止液体从滤纸和漏斗壁之间流下;C错,胶头滴管的尖嘴部分不能直接伸入试管里滴加液体,以免沾污试剂;D正确;
本题难度:简单
3、选择题 下列实验操作或实验事故处理正确的是?
[? ]
参考答案:A
本题解析:
本题难度:简单
4、填空题 氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验: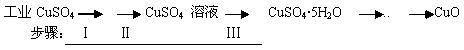
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
参考答案:(17分)⑴ 溶解(2分)、过滤(2分)?⑵①2Fe2++H2O2 +2H+=2Fe3++2H2O(3分)?②3.7-6.0(2分)
⑶ 冷却结晶(2分)?防止CuSO4·5H2O晶体分解(2分)
⑷ 错误 (1分)?根据控制变量的思想,所用溶液的阴离子不同,无法比较阳离子的催化效率(2分)
(5)酸性?大于 形成原电池? 2.2×10-8
本题解析:(1)步骤Ⅰ的目的是除不溶性杂质,所以所需操作的名称是溶解和过滤。
(2)①双氧水具有氧化性,能把亚铁离子氧化生成铁离子,则H2O2溶液除去硫酸亚铁的离子方程式是2Fe2++H2O2 +2H+=2Fe3++2H2O。
②氢氧化铜开始沉淀的pH是6。0,氢氧化铁完全沉淀的pH是3.7,所以调整pH 的范围应该在3.7~6.0之间。
(3)溶液加热蒸发至有晶膜出现时,停止加热,然后冷却结晶即可。水浴加热便于控制温度,可以防止CuSO4·5H2O晶体分解。
(4)根据控制变量的思想,所用溶液的阴离子不同,无法比较阳离子的催化效率,所以结论是错误的。
(5)硫酸铜溶于水,铜离子水解,溶液显酸性。由于1个铜离子水解生成2个氢离子,所以溶液中阳离子总数是增加的。铁能和硫酸铜发生置换反应,生成铜,从而构成原电池,加快反应速率。溶液的pH=8,则溶液中OH-的浓度是10-6mol/L,则根据氢氧化铜的溶度积常数可知,溶液中c(Cu2+)=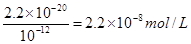 。
。
点评:该题是高考中的常见题型,难度大,对学生的要求高。有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
5、选择题 根据实验目的判断下列实验操作或装置正确的是
[? ]
A. 
B.?
C. 
D. 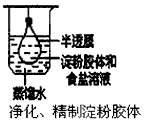
参考答案:D
本题解析:
本题难度:一般