时间:2017-08-10 00:43:33
1、选择题 我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:
气体A的饱和溶液 A和食盐的饱和溶液
A和食盐的饱和溶液 悬浊液
悬浊液 晶体
晶体 纯碱
纯碱
则下列叙述错误的是( )
A.A气体是NH3,B气体是CO2
B.把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉
C.纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
参考答案:D
本题解析:
本题难度:简单
2、简答题 某研究性学习小组学习了工业“侯氏制碱法”的原理后:
[提出问题]能否在实验室模拟“侯氏制碱法”中制取NaHCO3的过程呢?
[实验原理]写出候氏制碱法反应的化学方程式为______.[实验验证]如图是该学习小组进行模拟实验时所用到的部分主要装置.
请回答下列问题:
(1)检验A装置气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若______,说明装置不漏气.
(2)D是连接在装置A与装置C之间的气体净化装置,进气口是______(填a或b),D的作用是除去______气体.可否将瓶内试剂换为碳酸钠溶液______(填“可”“否”).
(3)实验时先向饱和NaCl溶液中通入较多的______,再通入足量的______,其原因是______.(填写序号)
①使CO2更易被吸收?②NH3比CO2更易制取?③CO2的密度比NH3大
(4)用______的方法将生成的NaHCO3晶体从混合物中分离出来.
如果要制得纯碱,还需发生的反应是(写出反应的化学方程式):______.
[得出结论]利用“侯氏制碱法”在实验室可以制取NaHCO3.
参考答案:候氏制碱法是用二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(1)随水的注入管内加压增大,漏斗内液体不能再流入试管,使长颈漏斗与管内液面出现液面差,并且液面差保持不变,说明装置气密性良好;
故答案为:长颈漏斗中注入水,漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降;
(2)气体从a管通入时才能使气体通过溶液而达到净化气体的目的;装置D内盛放的碳酸氢钠溶液能与混在气体中的HCl发生反应生成氯化钠、水和二氧化碳,从而除去混在气体中的HCl;若换做碳酸钠溶液,二氧化碳也会被吸收;
故答案为:a;氯化氢(或HCl);否;
(3)先通入氨气,氨气与水形成呈碱性的氨水可与二氧化碳与水生成的碳酸发生反应,更有利于二氧化碳气体的吸收;
故答案为:NH3;CO2;①;
(4)通过过滤,可把混在溶液中的碳酸氢钠晶体分离出来;如果制得纯碱需要对碳酸氢钠固体加热分解得到,反应化学方程式为:2NaHCO3?△?.?Na2CO3+H2O+CO2↑
故答案为:过滤.2NaHCO3?△?.?Na2CO3+H2O+CO2↑
本题解析:
本题难度:一般
3、简答题 纯碱(Na2CO3)在生产生活中具有广泛的用途.图1是实验室模拟制碱原理制取Na2CO3的流程图.
已知:向饱和食盐水中通入NH3、CO2后发生和反应为NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-等.
精制除杂的步骤顺序a→______→______→______→b(填字母编号).
a.粗盐溶解,滤去沉渣.b.加入盐酸调pH;c.加入Ba(OH)2溶液;d.加入Na2CO3溶液;e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是______.
(2)灼烧固体A制Na2CO3在______(填字母序号)中进行.
a.坩埚b.蒸发皿c.烧杯d.锥形瓶
证明滤液A中含有NH4+的方法是______.
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3.使pH降低,反应的离子方程式______.
(3)图2装置中常用于实验室制备CO2的是______(填字母编号);用b示意的装置制备NH3,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂______(填试剂名称).
(4)一种天然碱晶体成分是aNa2CO3?bNa2CO3?cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实骏方案.(仪器自选)请把实验方案填全:供选择的试剂:1mol?L-1H2SO4溶液、1.0mol?L-1BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水.
①称取m1g一定量天然碱晶体样品,溶于适量蒸馏水中.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
参考答案:(1)SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、Ba(OH)2溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,过滤,最后加入盐酸,NH3易溶于水,有利于吸收溶解度不大的CO2,所以向饱和食盐水中先通入NH3,后通人CO2,
故答案为:c;d;e;NH3易溶于水,有利于吸收溶解度不大的CO2;
(2)灼烧固体碳酸氢钠制Na2CO3,在坩埚加热分解,
取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有
NH4+,NH4+和HCO3-都能与氢氧化钠反应:NH4++HCO3-+2OH-=NH3?H2O+CO32-+H2O,
故答案为:a;取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;NH4++HCO3-+2OH-=NH3?H2O+CO32-+H2O;
(3)实验室制取二氧化碳常选用石灰石和稀盐酸或大理石和稀盐酸反应制取,采用固体+液体不加热
本题解析:
本题难度:一般
4、填空题 我国化学家侯德榜改革国外的制碱工艺提出的“侯氏制碱法”誉满全球。其生产步骤如下图所示:
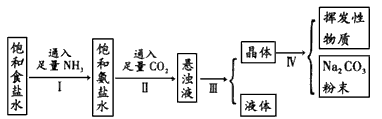
参考答案:(1)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(2)大
(3)由于CO2在水中溶解度很小,再通NH3也不能产生大量的HCO3-,故不可能析出NaHCO3晶体
(4)过滤 ;灼烧
本题解析:
本题难度:一般
5、填空题 纯碱是工业生产的重要原料,很长一段时间内纯碱的制法被欧美国家所垄断。上个世纪初我国著名的化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法)。并在天津建造了我国独立研发的第一家制碱厂。其制碱原理的流程如下
(1)侯德榜选择天津作为制碱厂的厂址有何便利条件:_________________ (举两例说明)。
(2)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是____、____(填化学式)。这两种气体在使用过程中是否需要考虑添加的顺序?____(填“需要”或“不需要”),原因是_____________。
(3)在沉淀池中发生反应的化学方程式是______________。
(4)联合制碱法使原料水中溶质的利用率从70%提高到90%以上,主要是设计了_________(填上述流程中的编号)。从母液中提取出的副产品的应用是____________(举一例)。
参考答案:(l)原料丰富、运输便利
(2)CO2;NH3;需要氨气在水中溶解度大,先通氨气后再通CO2产生碳酸氢铵多,有利于碳酸氢钠析出
(3)NaCl(饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(4)循环I;作化肥
本题解析:
本题难度:一般