时间:2017-08-10 00:43:11
1、填空题 将下列物质:①CH4、②Ar、③NH3、④MgO、⑤SiO2、⑥NaOH、⑦NH4Cl按要求填空
(1)微粒间只存在共价键的是___________,只存在离子键的是___________,既存在离子键,又存在共价键的是___________。
(2)属于离子化合物的是___________,其中只有离子键的化合物的电子式为___________。
(3)属于共价化合物的是___________。
参考答案:(1)CH4、NH3、SiO2;MgO;NaOH、NH4Cl
(2)MgO、NaOH、NH4Cl;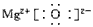
(3)CH4、NH3、SiO2
本题解析:
本题难度:一般
2、选择题 下列分子的电子式书写正确的是
[? ]
A.氨气: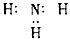
B.四氯化碳:
C.氮气: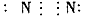
D.二氧化碳:
参考答案:C
本题解析:
本题难度:简单
3、填空题 我国已启动的“西气东输”工程是为了改善我国东部的能源结构,其中的“气”是指天然气,其主要成分的分子的电子式为__________,结构式为___________;分子里各原子的空间分布呈_________结构。
参考答案: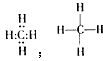 ;正四面体
;正四面体
本题解析:
本题难度:一般
4、选择题 下列关于中学化学中的“水”对应正确的是( )
A.蒸馏水--H2O
B.氯水--Cl2、H2O、HClO、H+、Cl-、ClO-、OH-(少量)
C.王水--浓盐酸与浓硝酸的物质的量之比为1:3
D.硬水--含Mg2+、Ca2+的水,软水--不含Mg2+、Ca2+的水
参考答案:A.蒸馏水对应H2O,关系正确,故A正确;
B.氯水为混合物,水为溶剂及氯气与水的反应物,水不能对应其它微粒,故B错误;
C.王水指浓盐酸与浓硝酸的物质的量之比为3:1,故C错误;
D.硬水指含Mg2+、Ca2+较多的水,软水指含Mg2+、Ca2+较少的水,故D错误;
故选A.
本题解析:
本题难度:简单
5、选择题 1824年法国巴拉尔发现溴。在他以前,有一家工厂曾将一瓶红棕色的液体送给德国化学家李比希检测,李比希凭经验武断地认为该液体为氯化碘(化学式为ICl,性质和溴非常相似)。后来看到巴拉尔发现溴的报道后,忏悔不已。下列关于ICl的有关说法中不正确的是(? )
A.I—Cl键为极性共价键
B.ICl分子为共价化合物分子
C.该物质在反应中通常体现氧化性
D.在反应ICl+2NaOH====NaCl+NaIO+H2O中作氧化剂
参考答案:D
本题解析:由于ICl性质和Br2相似,Br2在反应中通常作氧化剂(包括在与氢氧化钠反应中),因此该物质在反应中通常做氧化剂,呈现氧化性。但应该注意在ICl+2NaOH="===NaCl+" NaIO+H2O反应中,ICl各种元素的化合价并没有改变,因此不是氧化剂。因此本题答案为D项。卤素互化物(如ICl)性质和卤素单质相似,但它们是化合物。ICl中各元素的化合价分别为+1和-1价。
本题难度:简单